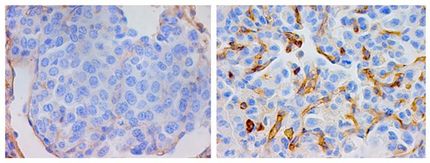
Kranke embryonale Herzen können sich bis zur Geburt regenerieren
Oskar-Lapp-Preis für Kardiologen vom MDC
Das embryonale Herz kann sich, im Gegensatz zum ausgewachsenen, adulten Herzen, nach einer Schädigung regenerieren. Das hat Dr. med. Jörg-Detlef Drenckhahn vom Max-Delbrück-Centrum für Molekulare Medizin (MDC) Berlin-Buch jetzt erstmals in Herzen weiblicher Mäuse zeigen können. Die Herzen der Tiere hatten sich im Verlaufe der Embryonalentwicklung bis zur Geburt nahezu vollständig erholt. Für diese grundlegende Erkenntnis erhielt er im Rahmen der 73. Jahrestagung der Deutschen Gesellschaft für Kardiologie- Herz- und Kreislaufforschung e.V. (DGK) den mit 10.240 Euro dotierten Oskar-Lapp-Preis.
Dr. Drenckhahn erforscht die genetischen und molekularen Ursachen vorgeburtlicher und frühkindlicher Herzmuskelerkrankungen (Kardiomyopathien), deren Defekt auf dem X-Chromosom vermutet wird. Sie führen bei Jungen bereits im Mutterleib zum Tod, Mädchen sterben im Alter von ein bis zwei Jahren. In diesem Zusammenhang untersucht Dr. Drenckhahn in Mäusen die Rolle eines Gens, dessen Genprodukt, das Enzym Holocytochrom c Synthase (Hccs), für die zelluläre Energiegewinnung in den Mitochondrien, den Kraftwerken der Zellen, unabdingbar ist. Forscher vermuten deshalb, dass das Gen, wenn es defekt ist, bei diesen Kardiomyopathien eine Rolle spielt.
Dabei ist schon länger bekannt, dass Störungen im zellulären Energiehaushalt schwerwiegende Folgen für das Herz haben. Herzmuskelzellen benötigen sehr viel mehr Energie als die meisten anderen Zellen, da sie ständig kontrahieren, um das Blut durch den Körper zu pumpen und damit die Sauerstoff- und Nährstoffversorgung des Organismus sicherzustellen. Das Herz ist deshalb in der Embryonalentwicklung auch eines der ersten Organe, das funktionstüchtig sein muss, um das Überleben des Embryos zu sichern.
Das Gen Hccs befindet sich nur auf den X-Chromosomen. Um die Funktion des Gens zu untersuchen und zu sehen, ob es tatsächlich an frühkindlichen Herzmuskelerkrankungen beteiligt ist, schaltete Dr. Drenckhahn in Herzmuskelzellen von Mäuseembryonen Hccs aus. Nach der Hälfte der Embryonalentwicklung zeigte sich, dass der Gendefekt für die männlichen Mäuseembryonen tödlich war, ebenso für die Weibchen, die zwei defekte Genkopien trugen.
Die weiblichen Mäuseembryonen, die in ihren Zellen jeweils ein gesundes und ein defektes X-Chromosom tragen, inaktivieren in einem zufälligen Prozess in jeder Zelle eines der beiden. Daraus ergibt sich, dass 50 Prozent ihrer Zellen im Herzen gesund sind. Die anderen 50 Prozent tragen den Defekt im zellulären Energiehaushalt und sind somit geschädigt. Obwohl solch eine Schädigung eigentlich keine normale Herzfunktion erlaubt, waren die neugeborenen Mäuse jedoch alle gesund und hatten keinerlei Herzprobleme. Wie Dr. Drenckhahn zeigen konnte, war der Anteil an kranken Herzzellen bis zur Geburt von 50 auf zehn Prozent gesunken. Die gesunden Zellen hatten den Verlust an funktionstüchtigem Gewebe kompensiert, indem sie sich schneller teilten. So hatte das Herz bei der Geburt überwiegend gesunde Herzmuskelzellen mit intakter Energiegewinnung, was das Überleben des Embryos bzw. des Neugeborenen sicherte. Allerdings, so Dr. Drenckhahn, bekam ein kleiner Teil dieser Mäuse im höheren Alter Herzrhythmusstörungen und Herzmuskelerkrankungen, einige starben an plötzlichem Herztod. Dies ist sehr wahrscheinlich auf den kleinen Teil defekter Zellen zurückzuführen, die noch im Herzen verbleiben.
Noch ist unklar, welche grundlegenden Prozesse bei der Regeneration der embryonalen Mäuseherzen eine Rolle spielen. Auch ist noch völlig unbekannt, welche Zellarten daran mitwirken und welche Signalwege daran beteiligt sind. Dr. Drenckhahn hofft, dass die weitere Erforschung dieses Vorgangs fundamentale Einblicke in die embryonale Entwicklung sowie die molekularen Regenerationsmechanismen des Herzens gibt. Nach der Geburt kann sich das Herz nicht oder nur sehr begrenzt regenerieren, da die Herzmuskelzellen die Fähigkeit zur Zellteilung verlieren. Die Aufklärung der embryonalen Herzregeneration könnte daher in Zukunft helfen, Therapien für die geschädigten Herzmuskeln von Kindern und Erwachsenen zu entwickeln.
Meistgelesene News
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Ab sofort nichts mehr verpassen: Unser Newsletter für Biotechnologie, Pharma und Life Sciences bringt Sie jeden Dienstag und Donnerstag auf den neuesten Stand. Aktuelle Branchen-News, Produkt-Highlights und Innovationen - kompakt und verständlich in Ihrem Posteingang. Von uns recherchiert, damit Sie es nicht tun müssen.