Struktur von synaptischen Vesikeln beschrieben
Mit quantitativen Analysen unter anderem der Proteindichte von synaptischen Vesikeln hat jetzt eine internationale Forschungsgruppe deren molekulare Struktur erforscht. In einer langen Serie von Experimenten haben 22 Wissenschaftler um Reinhard Jahn am Max-Planck-Institut für Biophysikalische Chemie über viele Jahre hinweg Daten gesammelt und analysiert. Die Ergebnisse geben einen Einblick in den Aufbau dieser kleinen, aber sehr wichtigen Bauteile von biologischen Zellen.
Obwohl das Prinzip der synaptischen Signalübertragung seit Jahrzehnten bekannt ist, sind die zugrundeliegenden molekularen Mechanismen bis heute noch nicht vollständig aufgeklärt. Die Neurotransmitter sind in kleinen Vorratsbehältern ("Vesikeln") in der Zelle gespeichert, die sich bei Bedarf mit der Zellwand verbinden und nach außen hin öffnen und entleeren. Zahl und Verfügbarkeit der Vesikel sind für die Schaltprozesse von entscheidender Bedeutung, genauso wie die Schnelligkeit, mit der die Vesikel ihren Inhalt freigeben. Wie das im einzelnen geschieht, ist nicht bekannt, aber man hat in den letzten Jahren entscheidende molekulare Schritte in diesem Ablaufs identifiziert. Eine besondere Rolle spielen dabei sog. "SNARE"-Proteine, die dafür sorgen, dass sich die Vesikel an die Zellwand anlagern, dass sich Vesikelhülle und Zellhülle verbinden und sich schließlich auch nach außen hin öffnen.
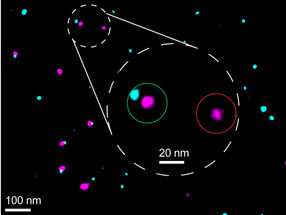
Alle diese Schritte sind nicht direkt sichtbar; die beteiligten Strukturen sind zu klein, als dass man sie mit herkömmlichen Lichtmikroskopen betrachten könnte. Um trotzdem Licht in das Dunkel zu bringen, hat Prof. Reinhard Jahn seit vielen Jahren die quantitative Analyse der molekularen Bestandteile von Vesikeln vorangetrieben, um daraus Rückschlüsse auf deren Aufbau ziehen zu können. Das ist jetzt gelungen. Aus vielen verschiedenen Untersuchungen mit über 20 beteiligten Wissenschaftlerinnen und Wissenschaftlern weltweit ergibt sich ein Bild, wie Vesikel aufgebaut sind, welche Proteine in welcher Menge auf ihrer Oberfläche gelagert sind und wie sich die SNARE-Proteine dazwischen verteilen.
Dies sei das erste atomare Modell einer zellulären Struktur (Organelle) überhaupt, betont Prof. Thomas C. Südhof von der University of Texas. Überraschend war vor allem die unerwartet hohe Dichte von Proteinen auf der Vesikel-Oberfläche. "Bisher hat man sich Membranen als glatte Lipid-Doppelschichten vorgestellt, in denen Proteine umherschwimmen wie Eisberge im Meer," kommentierte Reinhard Jahn seine Befunde. "Tatsächlich ist aber ein Viertel der Membran von Bereichen mit Vesikelproteinen ausgefüllt, die durch die Membran hindurchreichen. Und die Oberfläche ist nahezu vollständig mit Proteinen bedeckt." Das sind nicht nur SNARE-Proteine, die in großer Zahl vorkommen, sondern auch viele Varianten mit ganz anderen Funktionen und möglichen Aufgaben.
Die Experimente haben neue Fragen aufgeworfen, die Prof. Jahn jetzt angehen will. Eine davon ist: Wie unterscheiden sich Vesikel mit verschiedenen, erregenden oder hemmenden Neurotransmittern? Der Erfolg der bisherigen Messungen lässt hoffen, dass auch diese Fragen irgendwann einmal beantwortet werden können - spätestens in weiteren 15 Jahren. [hcn]
Originalveröffentlichung: Shigeo Takamori et al.: "Molecular Anatomy of a Trafficking Organelle", Cell 2006, 127, 831-846.
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Ab sofort nichts mehr verpassen: Unser Newsletter für Biotechnologie, Pharma und Life Sciences bringt Sie jeden Dienstag und Donnerstag auf den neuesten Stand. Aktuelle Branchen-News, Produkt-Highlights und Innovationen - kompakt und verständlich in Ihrem Posteingang. Von uns recherchiert, damit Sie es nicht tun müssen.