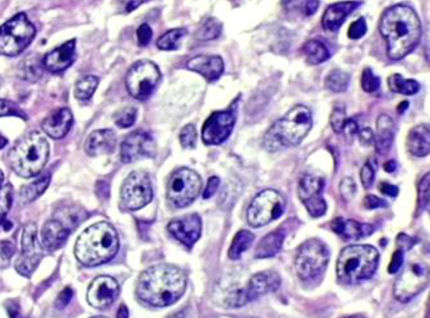
Biofrontera beginnt Phase IIb/III Studie zur Behandlung von aktinischer Keratose
Biofrontera AG gab bekannt, dass das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) und die zuständige Ethikkommission die Genehmigung zum Beginn der klinischen Phase IIb/III Studie zur Behandlung von aktinischer Keratose mit BF-200 ALA erteilt haben. Die an der Studie beteiligten Ärzte beginnen jetzt mit der Rekrutierung der Patienten, mit deren Hilfe die optimale Dosierung, Wirksamkeit und Sicherheit von BF-200 ALA untersucht wird. Biofronteras marktnächstes Produkt BF-200 ALA kombiniert eine Nanoemulsion mit der Wirksubstanz 5-Aminolävulinsäure (ALA), einem Wirkstoff, der in der photodynamischen Therapie zur Behandlung von präkanzerösen und kanzerösen Hautveränderungen eingesetzt wird.
Die genehmigte klinische Studie beinhaltet im ersten Teil eine Dosisfindung mit drei ALA-Konzentrationen und Placebo an insgesamt 80 Patienten. Nach einer Zwischenauswertung wird die Konzentration von ALA ausgewählt, die im zweiten, Phase III-Teil der Studie getestet wird. In diesem Teil der Studie werden weitere 160 Patienten eingeschlossen, von denen 120 Patienten mit BF-200 ALA und weitere 40 Patienten mit Placebo behandelt werden. Die klinische Studie ist randomisiert, Placebo-kontrolliert und wird an 13 dermatologischen Zentren in Deutschland durchgeführt. Die Wirksamkeit und Sicherheit der Kombination von ALA mit Nanoemulsionen wurde zuvor in Phase II Studien belegt.
Meistgelesene News
Weitere News aus dem Ressort Forschung & Entwicklung

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Ab sofort nichts mehr verpassen: Unser Newsletter für Biotechnologie, Pharma und Life Sciences bringt Sie jeden Dienstag und Donnerstag auf den neuesten Stand. Aktuelle Branchen-News, Produkt-Highlights und Innovationen - kompakt und verständlich in Ihrem Posteingang. Von uns recherchiert, damit Sie es nicht tun müssen.