Wilex: Finale Phase II-Daten zu MESUPRON bestätigen eindrucksvolle Verlängerung des Gesamtüberlebens
Das biopharmazeutische Unternehmen WIilex AG gab bekannt, dass die klinische Phase II-Kombinationsstudie mit dem oral verabreichbaren Arzneimittelkandidaten MESUPRON(R) in der Indikation Bauchspeicheldrüsenkrebs erfolgreich abgeschlossen wurde. Die finalen Auswertungen bestätigen die im September 2009 veröffentlichten vorläufigen Daten, u.a. die Verbesserung des Tumoransprechens und die Verlängerung des Gesamtüberlebens.
Prof. Dr. Volker Heinemann, Klinikum Großhadern, Universität München, Leiter der klinischen Prüfung, erklärt: 'Die Ergebnisse hinsichtlich Tumoransprechrate und Überlebensraten sind beeindruckend und markieren einen wichtigen Fortschritt in der Behandlung von Krebspatienten mit einem dringend benötigten neuen und gut verträglichen Therapieansatz. Mediziner und Patienten sehen mit großer Hoffnung auf die weitere Entwicklung von MESUPRON(R).'
Informationen über MESUPRON(R) und das uPA-Programm
Das Urokinase Plasminogen Aktivator-Enzymsystem (uPA), welches durch MESUPRON(R) gehemmt werden soll, spielt eine wichtige Rolle beim Wachstum und bei der Metastasierung von verschiedenen bösartigen Tumoren. Dies wurde auf der Basis einer Metaanalyse von 18 unterschiedlichen europäischen Studien zur Dauer der Überlebenszeit in Relation zum uPA-Gehalt im Tumor mit insgesamt über 8.300 Patienten festgestellt. Der tumorassoziierte Proteolysefaktor uPA und sein Inhibitor PAI-1 sind die einzigen tumorbiologischen Faktoren, die den höchsten 'Level of Evidence' (LOE1) für ihre prognostische und prädiktive Bedeutung erreicht haben.
MESUPRON(R) ist der erste uPA-Inhibitor weltweit, der sich in der klinischen Entwicklung befindet und in einer Phase II-Studie bei Krebspatienten eine positive Aktivität zeigen konnte. MESUPRON(R) könnte das Potenzial haben, eine Krebserkrankung wie eine chronische Krankheit langfristig und nebenwirkungsarm zu behandeln.
Informationen zur Studie
In der abgeschlossenen Phase II-Studie wurden Patienten mit lokal fortgeschrittenem, inoperablem, nicht metastasiertem Bauchspeicheldrüsenkrebs mit MESUPRON(R) zusammen mit dem Chemotherapeutikum Gemcitabine (Gemzar(R), Eli Lilly and Company, USA) behandelt. Die Studie ist randomisiert, offen und dreiarmig. Den Patienten wurde entweder Gemcitabine allein oder zusammen mit einer täglichen oralen Dosis von 200 mg bzw. 400 mg MESUPRON(R) bis zur Progression verabreicht. Wie in den acht abgeschlossenen Phase I-Studien gezeigt, hat sich MESUPRON(R) wieder als sicher und gut verträglich erwiesen.
Darüber hinaus wird MESUPRON(R) in Kombination mit dem Chemotherapeutikum Capecitabine (Xeloda(R), Hoffmann La Roche AG, Schweiz) bei Patienten mit metastasiertem, HER2-Rezeptor-negativem Brustkrebs in einer Phase II-Studie getestet.
Die Ergebnisse werden auf der Jahrestagung der American Society of Clinical Oncology (ASCO) bekannt gegeben, die vom 4. bis 8. Juni 2010 in Chicago, USA, stattfindet.
Meistgelesene News
Themen
Organisationen
Weitere News aus dem Ressort Forschung & Entwicklung

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Ab sofort nichts mehr verpassen: Unser Newsletter für Biotechnologie, Pharma und Life Sciences bringt Sie jeden Dienstag und Donnerstag auf den neuesten Stand. Aktuelle Branchen-News, Produkt-Highlights und Innovationen - kompakt und verständlich in Ihrem Posteingang. Von uns recherchiert, damit Sie es nicht tun müssen.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte

Neue KI-Plattform entwickelt Krebsmedikamente der Zukunft - "Vor ein paar Jahren war KI ein Schimpfwort in der Pharmaindustrie, aber jetzt ist der Trend genau das Gegenteil..."
Achema hat in Frankfurt begonnen

Siegthalerfabrik GmbH - Siegen, Deutschland
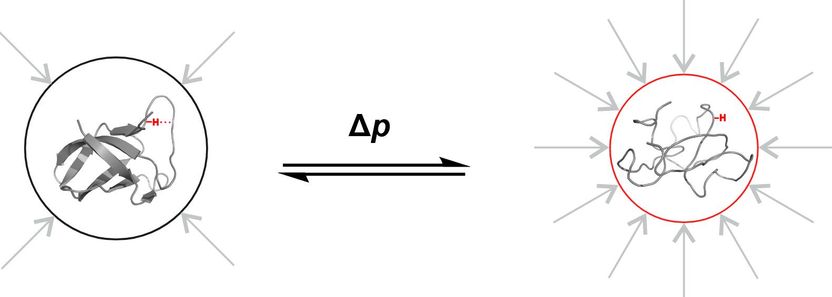
Forschung unter Hochdruck - Warum 3.000 Bar nötig sind, um einen umfassenden Blick auf ein Protein zu werfen
Fischen im Proteinmeer - Zusammensetzung von Spleißkomplex in Chloroplasten erstmals identifiziert
Arzneimittelversandhandel ohne drastische Einschnitte nicht sinnvoll - Cap Gemini Ernst & Young legt vergleichende Studie USA/Deutschland vor
Royal Tropical Institute - Amsterdam, Niederlande