Bitterkalt und außerordentlich scharf
Neue Methoden ermöglichen den Blick in unser Innerstes: Hochauflösende Bilder tiefgefrorener Zellen zeigen Strukturen, die zuvor nur erahnt werden konnten
Anzeigen
Bei Temperaturen von minus 196 Grad Celsius gelingen hochauflösende Bilder aus dem Zellinneren. Forschende am Institute of Science and Technology (IST) Austria zeigen so erstmals, wie ein bestimmter Proteinkomplex, der eine wichtige Rolle in diversen biologischen Prozessen wie der Zellbewegung spielt, in seinem aktiven Zustand tatsächlich aussieht.
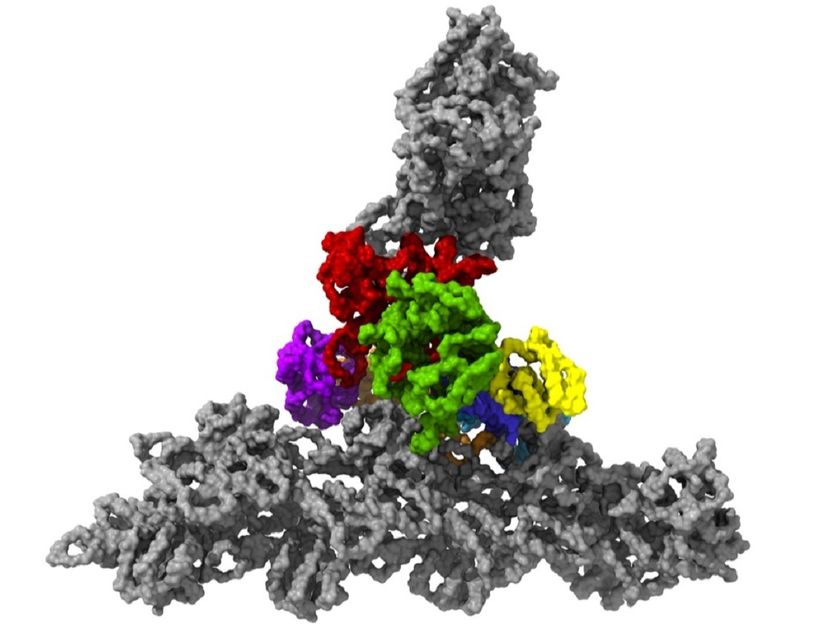
Der Proteinkomplex Arp2/3 mit seinen sieben Untereinheiten (farbig) bei der Bindung an Aktinfilamente (grau).
Florian Fäßler / IST Austria
Die Zellen in unserem Körper sind in Bewegung. Manche wandern von A nach B, um Wunden zu heilen oder Krankheitserreger unschädlich zu machen. Dabei helfen ihnen kleine Füßchen an der Vorderseite der Zelle, so genannte Lamellipodien. Diese flachen Ausstülpungen werde von der Zelle nach vorne geschoben, haften an der Oberfläche und ziehen dann die restliche Zelle nach. Im Innern der Füßchen befindet sich ein dichtes Netz ineinander verwobener Proteinfäden, genannt Aktinfilamente, die das Zellskelett bilden. Wie genau die einzelnen Proteinfäden zusammengehalten werden, was also diesem Stoff des Lebens seine Stabilität verleiht, konnte bisher nur erahnt werden. Unklar war, wie der Proteinkomplex Arp2/3 neue Aktinfilamente aus bereits bestehenden sprießen lässt, um so das dichte Netzwerk zu bildet, das der Zelle ihre Schubkraft verleiht.
Die Qual der Wahl
Um die Struktur des Proteinkomplex Arp2/3 näher zu untersuchen, mussten sich Forschende bislang entscheiden: Sie konnten Arp2/3 aus der Zelle entnehmen, um ihn isoliert zu betrachten – dabei nimmt der Proteinkomplex, bestehend aus sieben verschiedenen Proteinen, allerdings eine andere, inaktive Form ein. In seiner aktiven Form konnte Arp2/3 bisher nur mittels Elektrotomographie untersucht werden, die Bilder in relativ geringer Auflösung liefert. „Die Aufnahmen aus der Elektrotomographie, die zeigen, wie der Proteinkomplex in einer künstlichen Umgebung an die Aktinfilamente gebunden ist, sind so ungenau, dass man nicht eindeutig sagen kann, wo die einzelnen Elemente des Komplexes sitzen müssen“, erklärt Florian Fäßler, Post-Doktorand in der Forschungsgruppe von IST Austria Professor Florian Schur.
Seit mehr als zwei Jahren sucht Florian Fäßler nach einer Möglichkeit, Arp2/3 in seiner natürlichen Umgebung so darzustellen, dass die einzelnen Strukturen genau analysiert werden können. Nun ist es gelungen: Er erstellte die ersten ultrahochauflösenden Bilder des Proteinkomplexes innerhalb der Lamellipodien von Mäusezellen, und zwar in seiner aktiven, aktingebundenen Konformation. „Wir haben uns gesagt: Okay, wir gehen in die Zelle, wo zwar die Umgebung viel komplexer ist, weil da nicht nur der Proteinkomplex und die Aktinfilamente sind, sondern alle möglichen anderen Sachen auch. Aber nur so haben wir es geschafft, dieses Netzwerk so zu erhalten, dass wir die Struktur der Verzweigungen ermitteln konnten“, so der Molekularbiologe Florian Schur.
Schockgefrostete Zellen
Möglich wurde das bei minus 196 Grad Celsius. Innerhalb von Millisekunden froren die Forscher die Zellproben ein – so schnell, dass sich keine Eiskristalle bilden konnten, die die feinen Strukturen in der Zelle zerstört hätten. Anschließend machten sie mithilfe eines besonders leistungsstarken Kryo-Elektronenmikroskops – dem österreichweit einzigen seiner Art – und dem Verfahren der Kryoelektronentomographie Bilder der Zellen aus verschiedenen Blickwinkeln. So sammelte das Team genug Daten, um die dreidimensionalen Strukturen von mehr als 10.000 Arp2/3 Komplexen in ihrem aktiven Zustand zu rekonstruieren. Mittels modernster Bildgebungsverfahren konnten sie ein 3D Modell des Proteinkomplexes mit einer Auflösung von weniger als einem Nanometer erstellen. Zum Vergleich: Ein menschliches Haar ist etwa 50.000 Nanometer dick. „Wir können jetzt relativ exakt beschreiben, welche Position der Proteinkomplex und seine Untereinheiten einnehmen und wie sie das Netzwerk aus Aktinfilamenten im Lamellipodium von zuvor lebendigen Zellen formen“, so Florian Fäßler. „Vor fünf Jahren hätte wahrscheinlich niemand gedacht, dass das überhaupt möglich ist“, ergänzt Schur.
Bis ans Limit
Mithilfe der weiterentwickelten Methodik konnte das Team ein früheres Modell widerlegen, das von sehr viel großflächigeren Verbindungen zwischen Arp2/3 und den Aktinfilamenten ausgegangen war. Andere Vorstellungen darüber, wie der Proteinkomplex reguliert wird und neue Aktinfilamente formt, konnten die Wissenschaftler hingegen bestätigen. Damit können Forschende weltweit nun besser verstehen, wie dieser wichtige Proteinkomplex reguliert und aktiviert wird. So können neue Erkenntnisse darüber gewonnen werden, welche Rolle Arp2/3 für die Beweglichkeit von Zellen, die Entstehung von Krankheiten und für viele weitere Prozesse spielt. „Was wir gemacht haben, ist, soweit zu gehen, wie es bei so komplexen Zellproben methodisch und auflösungstechnisch derzeit möglich ist. Mit der aktuellen Auflösung haben wir neue biologische Einblicke bekommen, aber es war auch ein methodischer Fortschritt zu zeigen: Es ist möglich“, zeigt sich Schur begeistert. Im Zuge seiner Arbeit am IST Austria möchte Florian Fäßler die Methode verbessern, um weitere Proteine darzustellen und zu sehen, wie weit man so ins Innere von Zellen vordringen kann. „Wir erkennen gerade erst das volle Potential der Kryoelektronentomographie“, so Schur.