Pas seulement une sauvegarde - la double spécificité de UBA6
Une cible potentielle pour le développement de médicaments
Des chercheurs du Centre Rudolf Virchow de l'Université de Würzburg ont dévoilé les structures cristallines de l'UBA6 en complexe avec l'ATP ou la protéine de type ubiquitine FAT10. Ces résultats fournissent les bases nécessaires à l'étude des rôles individuels de l'UBA6 dans l'attachement de l'ubiquitine ou de la FAT10 aux protéines cibles et des voies cellulaires en aval, avec des implications possibles dans l'étiologie de certaines tumeurs. Cette étude a été publiée dans la revue Nature Communications.
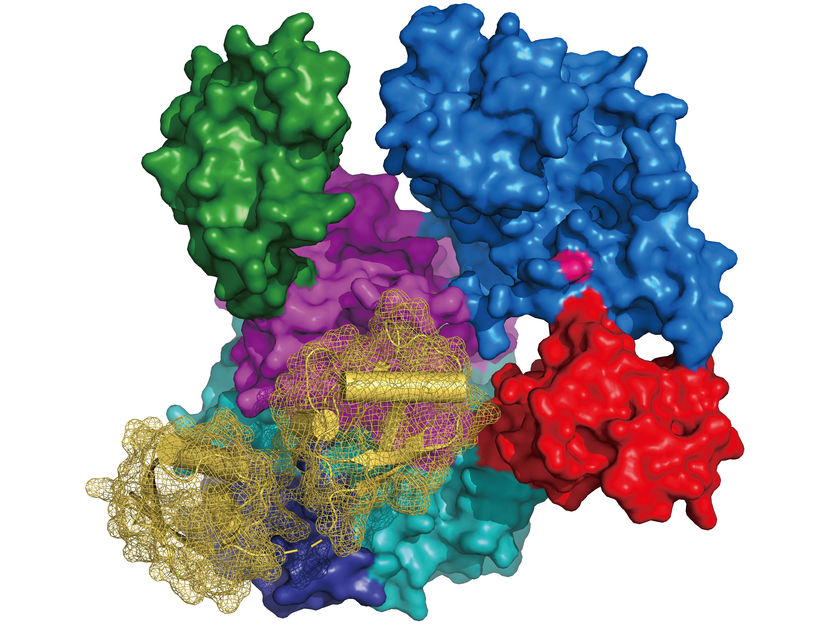
Structure de UBA6 (représentation de surface colorée selon l'architecture de son domaine, cystéine du site actif en rose) en complexe avec FAT10 (diagramme en ruban en jaune avec représentation de surface en maille).
Schindelin, RVZ
L'ubiquitylation des protéines cibles est l'une des modifications post-traductionnelles les plus importantes et joue un rôle essentiel dans de nombreux processus cellulaires. L'ubiquitylation est réalisée par une cascade enzymatique séquentielle d'enzymes activatrices E1, d'enzymes conjugatrices E2 et d'enzymes ligatrices E3. Pendant de nombreuses années, on a pensé que l'UBA1 était la seule enzyme E1 qui active l'ubiquitine, jusqu'à ce qu'en 2007, une deuxième enzyme activatrice d'ubiquitine soit découverte : L'UBA6.
Une cible potentielle pour le développement de médicaments
L'UBA6 est uniquement présente chez les vertébrés et les oursins. Fait intriguant, l'UBA6 est une enzyme E1 inhabituelle car elle active à la fois l'ubiquitine et la protéine de type ubiquitine (Ubl) FAT10. En raison de sa gamme restreinte d'événements d'ubiquitylation, par rapport à l'action de l'enzyme générique d'activation de l'ubiquitine UBA1, et du fait qu'elle est la seule E1 catalysant la fixation de la FAT10, l'UBA6 est considérée comme une cible médicamenteuse potentielle. Pour explorer plus avant l'inhibition ciblée de l'UAB6, il est essentiel de comprendre sa double spécificité et d'identifier les variantes de l'enzyme qui sont altérées soit dans l'activation de l'ubiquitine, soit dans l'activation du FAT10.
Le groupe de recherche du professeur Hermann Schindelin au centre Rudolf Virchow de l'université de Würzburg rapporte les premières structures de l'UBA6, en complexe avec l'ATP ou le FAT10. Fait intéressant, leurs études de structure et de modélisation ont également révélé comment l'UBA6 permet la double reconnaissance de l'ubiquitine et du FAT10. Une autre découverte importante est l'identification de variantes de l'UBA6 qui abolissent sélectivement l'activation de l'ubiquitine ou du FAT10. "Ces résultats fournissent les bases pour étudier les rôles individuels que joue UBA6 dans l'activation de l'ubiquitine ou de la FAT10 dans les voies cellulaires en aval", déclare Schindelin.
Enchevêtrés dans diverses maladies
L'ubiquitylation et la FAT10ylation étant impliquées dans de multiples processus cellulaires, il n'est pas surprenant que les dysfonctionnements d'un ou plusieurs composants de ce système conduisent à diverses maladies. La dégradation protéasomique médiée par l'UBA6 a été signalée comme étant impliquée dans des états physiologiques et physiopathologiques associés au cerveau chez la souris. Il est intéressant de noter que l'UBA6 est surexprimée dans le cerveau humain de patients atteints de la maladie d'Alzheimer. La protéine suppresseur de tumeur p53 est un substrat de FAT10 et une double régulation négative de FAT10 et p53 a été observée comme étant critique dans le contrôle de la tumorigenèse, ce qui est en accord avec la surexpression de FAT10 dans de nombreux types de cellules cancéreuses.
Alors que les prédictions concernant l'orientation de l'ubiquitine en complexe avec UBA6 pouvaient être facilement générées sur la base de la structure du complexe UBA6-ATP et des structures UBA1-Ub disponibles, il semblait impossible de prédire comment FAT10 et, en particulier, son domaine N-terminal (NTD) interagiraient avec UBA6. La détermination de la structure co-cristalline UBA6-FAT10 était donc une étape cruciale. Sur la base des structures obtenues expérimentalement et du modèle de complexe UBA6-ubiquitine, un commutateur de sélectivité a été identifié, ce qui a conduit à la découverte ultérieure de variantes d'UBA6 abolissant sélectivement l'activation de l'un ou l'autre modificateur.
De futures études sur l'UBA6 avec les mutants abolis sélectivement sont nécessaires pour étudier les liens possibles entre l'ubiquitylation catalysée par l'UBA6 et la FAT10ylation dans le contexte du cancer. "Si des relations de causalité peuvent être établies, l'inhibition ciblée d'UBA6 par des approches de criblage enzymatique et in silico sera réalisée", explique Schindelin. "Avec l'ensemble des mutans qui altèrent sélectivement l'ubiquitylation ou la FAT10ylation, nous étudierons l'altération sélective de l'un ou l'autre processus dans des expériences cellulaires, en nous concentrant particulièrement sur les cellules cancéreuses."
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.








































