No sólo un respaldo: la doble especificidad de UBA6
Un objetivo potencial para el desarrollo de fármacos
Investigadores del Centro Rudolf Virchow de la Universidad de Würzburg han desvelado las estructuras cristalinas de UBA6 en complejo con ATP o con la proteína similar a la ubiquitina FAT10. Estos resultados sientan las bases para estudiar las funciones individuales de la UBA6 en la unión de la ubiquitina o la FAT10 a las proteínas objetivo y las vías celulares posteriores, con posibles implicaciones en la etiología de ciertos tumores. Este estudio se ha publicado en la revista Nature Communications.
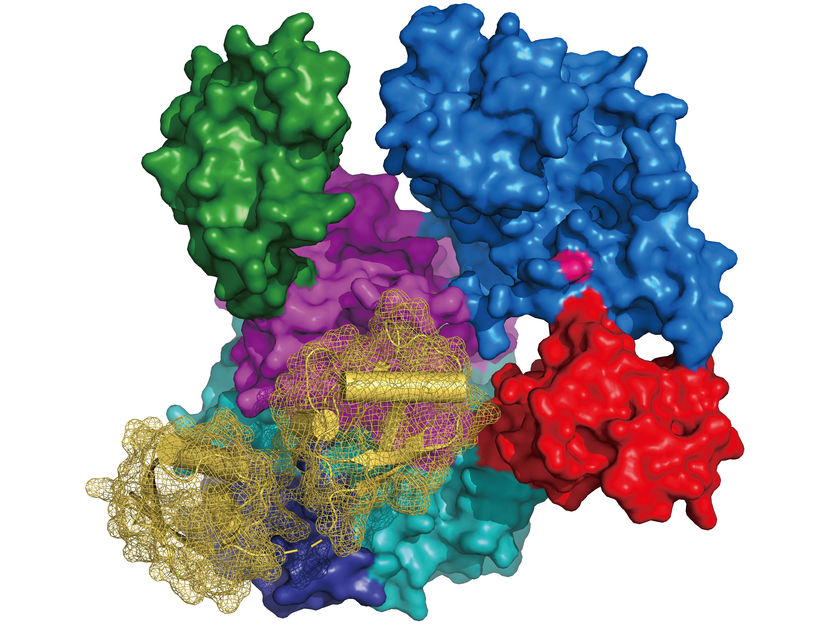
Estructura de UBA6 (representación de la superficie coloreada según la arquitectura de su dominio, cisteína del sitio activo en rosa) en complejo con FAT10 (diagrama de cinta en amarillo con representación de la superficie en malla).
Schindelin, RVZ
La ubiquitinación de las proteínas diana es una de las modificaciones postraduccionales más importantes y desempeña papeles esenciales en numerosos procesos celulares. La ubiquitlación se lleva a cabo mediante una cascada enzimática secuencial de enzimas activadoras E1, enzimas conjugadoras E2 y enzimas ligadoras E3. Durante muchos años se pensó que la UBA1 era la única enzima E1 que activaba la ubiquitina, hasta que en 2007 se descubrió una segunda enzima activadora de la ubiquitina: UBA6.
Un objetivo potencial para el desarrollo de fármacos
La UBA6 sólo está presente en los vertebrados y en los erizos de mar. Curiosamente, la UBA6 es una enzima E1 inusual, ya que activa tanto la ubiquitina como la proteína similar a la ubiquitina (Ubl) FAT10. Debido a su restringida gama de eventos de ubiquitilación, en comparación con la acción de la enzima activadora de ubiquitina genérica UBA1, y siendo la única E1 que cataliza la unión de FAT10, UBA6 se considera una potencial diana farmacológica. Para seguir explorando la inhibición selectiva de la UAB6, es esencial comprender su doble especificidad e identificar variantes de la enzima que estén deterioradas en la activación de la ubiquitina o de la FAT10.
El grupo de investigación del profesor Hermann Schindelin, del Centro Rudolf Virchow de la Universidad de Würzburg, presenta las primeras estructuras de la UBA6 en complejo con ATP o FAT10. Curiosamente, sus estudios estructurales y de modelización también revelaron cómo UBA6 permite el reconocimiento dual de ubiquitina y FAT10. Otro hallazgo clave es la identificación de variantes de UBA6 que suprimen selectivamente la activación de la ubiquitina o de FAT10. "Estos resultados sientan las bases para estudiar las funciones individuales que desempeña UBA6 en la activación de la ubiquitina o de FAT10 en las vías celulares posteriores", afirma Schindelin.
Enredado en varias enfermedades
Dado que la ubiquitinación y la FAT10 están implicadas en múltiples procesos celulares, no es de extrañar que el mal funcionamiento de uno o más componentes de este sistema dé lugar a diversas enfermedades. Se ha informado de que la degradación proteasomal mediada por UBA6 está implicada en estados fisiológicos y fisiopatológicos asociados al cerebro de los ratones. Curiosamente, se ha descubierto que la UBA6 está sobreexpresada en cerebros humanos de pacientes con la enfermedad de Alzheimer. La proteína supresora de tumores p53 es un sustrato de FAT10 y se observó que una regulación doblemente negativa de FAT10 y p53 es crítica en el control de la tumorigénesis, lo que está en consonancia con la sobreexpresión de FAT10 en muchos tipos de células cancerosas.
Mientras que las predicciones relativas a la orientación de la ubiquitina en complejo con UBA6 podían generarse fácilmente sobre la base de la estructura del complejo UBA6-ATP y de las estructuras disponibles de UBA1-Ub, parecía imposible predecir cómo FAT10 y, en particular, su dominio N-terminal (NTD) interactuarían con UBA6. Por lo tanto, la determinación de la estructura de co-cristal de UBA6-FAT10 fue un paso crucial. A partir de las estructuras derivadas experimentalmente y del complejo modelo UBA6-ubiquitina, se identificó un interruptor de selectividad que condujo al posterior descubrimiento de variantes de UBA6 que suprimen selectivamente la activación de cualquiera de los dos modificadores.
Se necesitan futuros estudios de UBA6 con los mutantes selectivamente deteriorados para investigar los posibles vínculos entre la ubiquitilación catalizada por UBA6 y la FAT10ilación en el contexto del cáncer. "Si se pueden establecer relaciones causales, se llevará a cabo la inhibición selectiva de UBA6 mediante enfoques de cribado enzimáticos e in silico", explica Schindelin. "Con el conjunto de mutaciones que deterioran selectivamente la ubiquitilación o la FAT10ilación investigaremos el deterioro selectivo de cualquiera de los dos procesos en experimentos basados en células con un enfoque particular en las células cancerosas".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.




































