Un éditeur de gènes perfectionné
Espacer les coupes
L'outil moléculaire CRISPR-Cas9 peut être utilisé pour traiter les troubles sanguins héréditaires, mais cela peut provoquer des altérations génétiques involontaires. Une équipe dirigée par les chercheurs du MDC Klaus Rajewsky et Van Trung Chu vient de présenter dans "Science Advances" une approche qui minimise ces conséquences négatives.
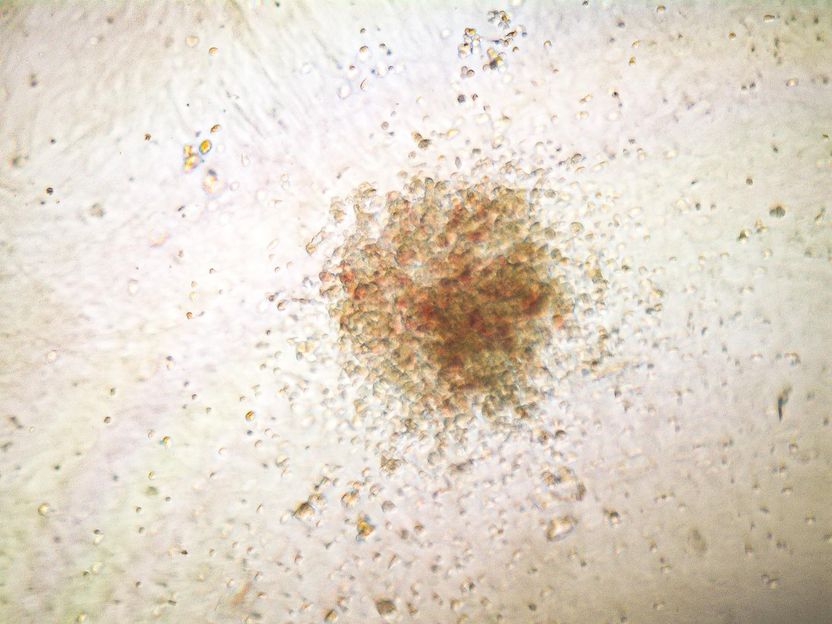
Colonie cellulaire différenciée à partir de cellules souches hématopoïétiques humaines réparées par gène. Seules les cellules souches réparées pouvaient former une telle colonie.
AG Klaus Rajewsky, MDC
Les espoirs sont grands quant au potentiel thérapeutique de l'outil d'édition génétique CRISPR-Cas9. Ces "ciseaux moléculaires" peuvent être utilisés pour découper et réparer très précisément les mutations génétiques responsables de maladies héréditaires. Mais malgré la précision avec laquelle l'outil est capable de localiser sa cible dans le génome, son travail n'est pas encore totalement exempt d'erreurs.
Parfois, les coupures sont effectuées sur des sites très similaires à la séquence cible, mais situés dans des régions entièrement différentes de l'ADN. Ces erreurs, que les scientifiques appellent "mutations hors cible", peuvent avoir des conséquences inattendues. Et même si CRISPR-Cas9 effectue sa coupe au bon endroit, des erreurs peuvent se produire lorsque la coupe est réparée - un phénomène connu sous le nom de "mutations on-target".
Espacer les coupes
"Ces erreurs se produisent principalement parce que, dans la méthode classique, les deux brins de la molécule d'ADN sont coupés en même temps", explique le professeur Klaus Rajewsky, chef du laboratoire de régulation immunitaire et de cancérologie du Centre Max Delbrück de médecine moléculaire de l'Association Helmholtz (MDC) de Berlin. Avec d'autres chercheurs du MDC et de la Humboldt-Universität zu Berlin, le scientifique a présenté dans la revue "Science Advances" une nouvelle approche affinée, baptisée "spacer-nick". Cette méthode fait appel à une paire de ciseaux moléculaires modifiés, appelés nickases, qui font des entailles sur des brins opposés de l'ADN à deux endroits différents.
Mais la plus grande précision avec laquelle ce duo d'éditeurs de gènes est capable de détecter et de réparer les gènes défectueux est en grande partie due à un espaceur que l'équipe a intégré à l'outil. "Nous utilisons cet espaceur pour faire en sorte que les deux entailles soient séparées de 200 à 350 paires de bases et que les cassures double brin dans l'ADN soient évitées", explique le Dr Van Trung Chu, chercheur au laboratoire Rajewsky et co-dernier auteur de l'article, avec Rajewsky lui-même. "Nos expériences avec des cellules souches hématopoïétiques et des cellules T ont montré qu'il s'agit de la distance optimale pour minimiser les mutations sur cible et hors cible", explique le Dr Chu. "Plus courte, et nous risquons de couper l'intégralité de la molécule d'ADN - malgré l'utilisation de deux ciseaux distincts."
Deux autres équipes du MDC - le laboratoire de cancérologie et d'immunologie / mécanismes immunitaires et anticorps humains du professeur Kathrin de la Rosa, et le laboratoire d'édition du génome et de modèles de maladies du Dr Ralf Kühn, dont Chu est également membre - ont également apporté des contributions importantes à l'article, notamment en termes de détection des mutations hors cible. "Spacer-nick est donc également un bon exemple de la collaboration fructueuse entre les chercheurs travaillant dans les différents laboratoires du MDC", déclare Rajewsky.
Efficace et presque sans erreur
Les scientifiques peuvent même quantifier la supériorité de leurs ciseaux génétiques finement ajustés et de leurs double-nicks décalés : "Avec la méthode classique CRISPR-Cas9, des mutations sur cible se produisent dans plus de 40 % des interventions", rapporte Chu. "Le système de double encoche décalée peut ramener ce chiffre à moins de deux pour cent". Le succès avec les mutations hors cible, explique Chu, ne peut pas être déterminé aussi facilement et précisément : "Tout ce que nous pouvons vraiment dire, c'est qu'elles se produisent relativement fréquemment lorsque les ciseaux génétiques classiques sont utilisés, mais qu'elles ont été rares, voire inexistantes, dans notre approche." Ce qui reste flou pour l'instant, c'est le mécanisme exact par lequel le matériel génétique est réparé à la suite des coupures espaceur-nick. "Il ne semble pas que cela se fasse par la voie bien connue - et sujette aux erreurs - du NHEJ", explique M. Chu.
En termes d'efficacité, le spacer-nick est comparable à l'outil conventionnel : "Avec les deux méthodes, nous sommes en mesure de réparer avec succès entre 20 et 50 % des cellules traitées", indique le professeur Chu. C'est probablement suffisant, explique-t-il, pour guérir les patients atteints d'un trouble sanguin héréditaire qui ne résulte que d'un seul gène altéré. Parmi les exemples de tels troubles, citons la bêta-thalassémie, qui implique une synthèse défectueuse de l'hémoglobine, un pigment du sang rouge, ou la neutropénie congénitale sévère, qui se caractérise par un nombre considérablement réduit de granulocytes - un type de globules blancs - et est associée à une défense immunitaire très affaiblie.
Réparer les cellules souches
Chu et Rajewsky espèrent que d'autres chercheurs reprendront leur idée et testeront le spacer-nick - d'abord sur des modèles animaux, puis bientôt sur les premiers patients humains. Chu explique que le principe de la thérapie est simple : Des cellules souches hématopoïétiques sont prélevées sur des personnes atteintes d'une maladie héréditaire monogénique selon des méthodes établies. Spacer-nick répare ensuite les gènes défectueux directement dans la culture cellulaire. Une fois que les ciseaux génétiques ont fait leur travail, les cellules souches réparées sont réinjectées dans le patient - où elles produisent de nouvelles cellules sanguines, et surtout, des cellules saines.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.