Cómo el cáncer hace que otras células trabajen para él
Las células cancerosas equipan a las células vecinas sanas con centrales eléctricas celulares adicionales para que trabajen para ellas. Así lo han demostrado investigadores de la ETH de Zúrich en un nuevo estudio. El cáncer utiliza así un mecanismo que a menudo sirve para reparar células dañadas.
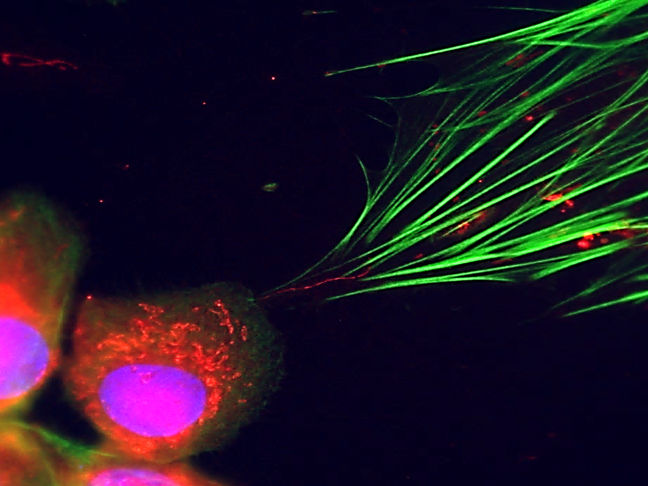
La microscopía de fluorescencia lo hace visible: las células cancerosas (abajo a la izquierda) pueden verse transfiriendo sus centrales energéticas celulares (puntos rojos) a las células del tejido conjuntivo a través de pequeños tubos (fina línea roja en el centro de la imagen). Su citoesqueleto está marcado en verde.
Michael Cangkrama / ETH Zürich
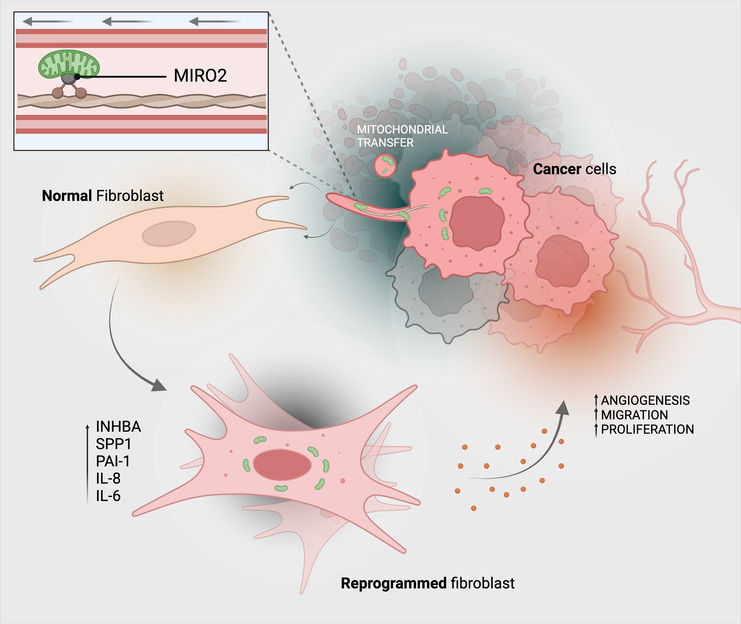
Así es como las células cancerosas transfieren sus mitocondrias (verde) a las células del tejido conjuntivo (fibroblastos).
Michael Cangkrama / ETH Zurich / BioRender

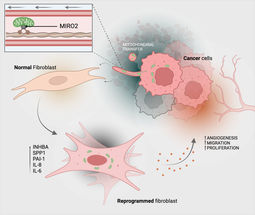
Los tumores han desarrollado muchas estrategias y trucos para obtener ventajas en el organismo. Investigadores de la ETH de Zúrich dirigidos por la profesora de biología celular Sabine Werner han descubierto ahora otro sorprendente truco que ciertos tumores utilizan para asegurar su supervivencia y crecimiento.
En un nuevo estudio, los biólogos demuestran que las células cancerosas de la piel pueden transferir sus mitocondrias a las células sanas del tejido conjuntivo (fibroblastos) de su entorno inmediato. Las mitocondrias son los compartimentos celulares que proporcionan energía en forma de la molécula ATP.
Para transportar las mitocondrias, las células cancerosas utilizan diminutos tubos formados por material de la membrana celular. Éstos conectan las dos células como un tubo neumático.
Reprogramación funcional
Mediante la transferencia mitocondrial, los fibroblastos se reprograman funcionalmente en fibroblastos asociados a tumores, que actúan principalmente contra las células cancerosas: Los fibroblastos asociados a tumores suelen multiplicarse más rápidamente que los fibroblastos normales y producen más ATP. También segregan mayores cantidades de factores de crecimiento y citoquinas. Todo ello beneficia a las células tumorales: también se multiplican más rápidamente, lo que hace que el tumor sea más agresivo.
Por último, pero no por ello menos importante, los fibroblastos capturados también organizan el entorno celular -la llamada matriz extracelular- aumentando la producción de determinados componentes de la matriz para que las células cancerosas se sientan cómodas. La matriz extracelular es importante para la estabilidad mecánica de los tejidos e influye en el crecimiento, la cicatrización de heridas y la comunicación entre células.
¿De hallazgo casual a terapia?
En realidad fue un hallazgo casual, dice Sabine Werner. Su antiguo investigador postdoctoral Michael Cangkrama descubrió diminutas conexiones en forma de tubo entre los dos tipos de células en un cultivo de fibroblastos y células de cáncer de piel en una placa de Petri. Así pudo demostrar que las mitocondrias se transportan de las células cancerosas a los fibroblastos a través de estas nanoconexiones.
El hecho de que las células puedan intercambiar mitocondrias a través de estas conexiones no es nada nuevo en sí mismo. Por ejemplo, los científicos descubrieron hace varios años que las células sanas del tejido nervioso transmiten sus orgánulos energéticos a las células nerviosas dañadas tras un derrame cerebral para garantizar su supervivencia. "En realidad, las células cancerosas utilizan un mecanismo ventajoso para las lesiones para sus propios fines. Esto les permite crecer hasta convertirse en un tumor maligno", explica Werner. Otros grupos de investigación han demostrado que las células del entorno tumoral pueden transmitir sus mitocondrias a las células cancerosas, lo que aumenta su aptitud. El hecho de que la transferencia mitocondrial también se produzca a la inversa, de una célula cancerosa de la piel a una célula sana del tejido conjuntivo, era desconocido hasta ahora.
En colaboración con otros grupos de investigación de la ETH de Zúrich, los investigadores hallaron pruebas de que esta transferencia también desempeña un papel en otros tipos de cáncer, como el de mama y el de páncreas. En este último es especialmente importante porque los tumores pancreáticos contienen muchos fibroblastos y el tejido conjuntivo es relativamente grande.
La proteína MIRO2 contribuye a la transferencia
Por último, los investigadores también han aclarado el mecanismo molecular de la transferencia mitocondrial. Ya se sabía que algunas proteínas contribuían al transporte de mitocondrias. Los investigadores examinaron cuáles de ellas están presentes en mayor número en las células cancerosas que transfieren mitocondrias. Dieron con la proteína MIRO2. "Esta proteína se produce en gran cantidad en las células cancerosas que transfieren sus mitocondrias", explica Werner.
Los investigadores detectaron MIRO2 no sólo en cultivos celulares, sino también en muestras de tejido humano, sobre todo en las células cancerosas de los bordes del tumor, que crecen de forma invasiva en el tejido y se producen muy cerca de los fibroblastos. "Por tanto, pudimos detectar MIRO2 exactamente donde sospechábamos que estaba", afirma el primer autor, Michael Cangkrama.
Se busca inhibidor
Los nuevos hallazgos ofrecen puntos de partida para detener el crecimiento de los tumores. Si los investigadores bloqueaban la formación de MIRO2, la transferencia mitocondrial también dejaba de funcionar y los fibroblastos no se convertían en fibroblastos promotores de tumores.
"El bloqueo de MIRO2 funcionó en el tubo de ensayo y en el modelo de ratón. Todavía no se ha investigado si también funciona en el tejido humano", afirma Werner. Los investigadores tienen que encontrar primero una molécula inhibidora de MIRO2 que tenga pocos efectos secundarios en el cuerpo humano. "Si esto tiene éxito, tal inhibidor podría trasladarse a la clínica a largo plazo". Sin embargo, podrían pasar años antes de que se desarrolle y pruebe una terapia.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Alemán se puede encontrar aquí.
Publicación original
Michael Cangkrama, Huan Liu, Xiaoyu Wu, Josephine Yates, James Whipman, Christoph G. Gäbelein, Mai Matsushita, Luca Ferrarese, Sibilla Sander, Francesc Castro-Giner, Simran Asawa, Magdalena K. Sznurkowska, Manfred Kopf, Jörn Dengjel, Valentina Boeva, Nicola Aceto, Julia A. Vorholt, Sabine Werner; "MIRO2-mediated mitochondrial transfer from cancer cells induces cancer-associated fibroblast differentiation"; Nature Cancer, 2025-8-28