Come il cancro fa lavorare le altre cellule per lui
Annunci
Le cellule tumorali dotano le cellule sane vicine di centrali elettriche cellulari aggiuntive per farle lavorare al posto loro. Lo hanno dimostrato i ricercatori del Politecnico di Zurigo in un nuovo studio. Il cancro utilizza quindi un meccanismo che spesso serve a riparare le cellule danneggiate.
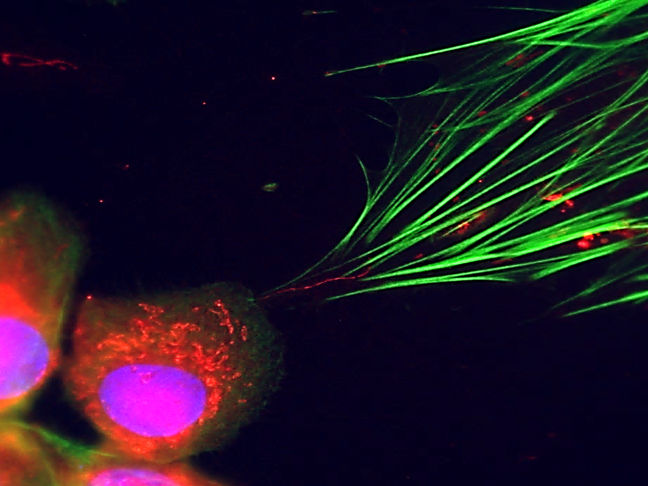
La microscopia a fluorescenza lo rende visibile: le cellule tumorali (in basso a sinistra) possono essere viste trasferire le loro centrali cellulari (punti rossi) nelle cellule del tessuto connettivo attraverso piccoli tubi (linea rossa sottile al centro dell'immagine). Il citoscheletro è evidenziato in verde.
Michael Cangkrama / ETH Zürich
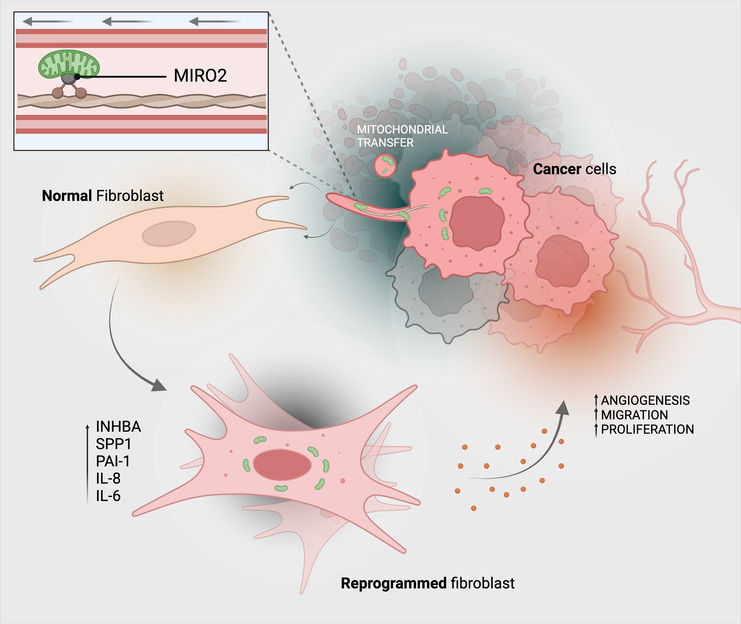
In questo modo le cellule tumorali trasferiscono i loro mitocondri (verdi) alle cellule del tessuto connettivo (fibroblasti).
Michael Cangkrama / ETH Zurich / BioRender

I tumori hanno sviluppato molte strategie e trucchi per ottenere vantaggi nell'organismo. I ricercatori del Politecnico di Zurigo, guidati dalla professoressa di biologia cellulare Sabine Werner, hanno ora scoperto un altro sorprendente trucco che alcuni tumori utilizzano per garantire la propria sopravvivenza e crescita.
In un nuovo studio, i biologi dimostrano che le cellule del cancro della pelle possono trasferire i loro mitocondri alle cellule sane del tessuto connettivo (fibroblasti) nel loro ambiente immediato. I mitocondri sono i compartimenti cellulari che forniscono energia sotto forma di molecola ATP.
Per trasportare i mitocondri, le cellule tumorali utilizzano piccoli tubi costituiti da materiale della membrana cellulare. Questi collegano le due cellule come un tubo pneumatico.
Riprogrammazione funzionale
Attraverso il trasferimento dei mitocondri, i fibroblasti vengono riprogrammati funzionalmente in fibroblasti associati al tumore, che lavorano principalmente verso le cellule tumorali: I fibroblasti associati al tumore di solito si moltiplicano più velocemente dei fibroblasti normali e producono più ATP. Inoltre, secernono maggiori quantità di fattori di crescita e citochine. Tutto questo va a vantaggio delle cellule tumorali: anch'esse si moltiplicano più velocemente, rendendo il tumore più aggressivo.
Infine, i fibroblasti catturati organizzano anche l'ambiente cellulare - la cosiddetta matrice extracellulare - aumentando la produzione di alcuni componenti della matrice in modo che le cellule tumorali si sentano a proprio agio. La matrice extracellulare è importante per la stabilità meccanica dei tessuti e influenza la crescita, la guarigione delle ferite e la comunicazione tra le cellule.
Da scoperta casuale a terapia?
In realtà si è trattato di una scoperta casuale, spiega Sabine Werner. Il suo ex ricercatore post-dottorato Michael Cangkrama ha scoperto piccole connessioni simili a tubi tra i due tipi di cellule in una coltura di fibroblasti e cellule di cancro della pelle in una piastra di Petri. È stato quindi in grado di dimostrare che i mitocondri vengono trasportati dalle cellule tumorali ai fibroblasti in queste nanocollegazioni.
Il fatto che le cellule possano scambiarsi mitocondri attraverso tali connessioni non è di per sé una novità. Ad esempio, alcuni anni fa gli scienziati hanno scoperto che le cellule sane del tessuto nervoso trasmettono gli organelli della loro centrale elettrica alle cellule nervose danneggiate dopo un ictus, per garantirne la sopravvivenza. "Le cellule tumorali in realtà utilizzano un meccanismo vantaggioso per le lesioni per i loro scopi. Questo permette loro di crescere fino a diventare un tumore maligno", spiega Werner. Altri gruppi di ricerca hanno dimostrato che le cellule dell'ambiente tumorale possono trasferire i loro mitocondri alle cellule cancerose, aumentandone la fitness. Il fatto che il trasferimento dei mitocondri avvenga anche al contrario, da una cellula di cancro della pelle a una cellula di tessuto connettivo sano, era finora sconosciuto.
In collaborazione con altri gruppi di ricerca del Politecnico di Zurigo, i ricercatori hanno trovato le prove che questo trasferimento svolge un ruolo anche in altri tipi di cancro, come il cancro al seno e il cancro al pancreas. In quest'ultimo è particolarmente importante perché i tumori del pancreas contengono molti fibroblasti e il tessuto connettivo è relativamente grande.
La proteina MIRO2 aiuta il trasferimento
Infine, i ricercatori hanno anche chiarito il meccanismo molecolare del trasferimento mitocondriale. Si sapeva già che alcune proteine aiutano il trasporto dei mitocondri. I ricercatori hanno esaminato quali di queste sono presenti in maggior numero nelle cellule tumorali che trasferiscono mitocondri. Si sono imbattuti nella proteina MIRO2. "Questa proteina è fortemente prodotta nelle cellule tumorali che trasferiscono i mitocondri", spiega Werner.
I ricercatori hanno individuato MIRO2 non solo nelle colture cellulari, ma anche in campioni di tessuto umano, in particolare nelle cellule tumorali ai margini del tumore, che crescono in modo invasivo nel tessuto e si trovano in stretta prossimità dei fibroblasti. "Siamo quindi riusciti a individuare MIRO2 esattamente dove sospettavamo che fosse", spiega il primo autore Michael Cangkrama.
Cercasi inibitore
Le nuove scoperte offrono punti di partenza per arrestare la crescita dei tumori. Se i ricercatori hanno bloccato la formazione di MIRO2, anche il trasferimento mitocondriale ha smesso di funzionare e i fibroblasti non si sono trasformati in fibroblasti promotori di tumori.
"Il blocco di MIRO2 ha funzionato in provetta e nel modello murino. Se funziona anche nei tessuti umani non è ancora stato studiato", afferma Werner. I ricercatori devono prima trovare una molecola inibitrice di MIRO2 che abbia pochi effetti collaterali nel corpo umano. "Se ciò avrà successo, tale inibitore potrebbe essere trasferito in clinica a lungo termine". Tuttavia, potrebbero passare anni prima che una terapia venga sviluppata e testata.
Nota: questo articolo è stato tradotto utilizzando un sistema informatico senza intervento umano. LUMITOS offre queste traduzioni automatiche per presentare una gamma più ampia di notizie attuali. Poiché questo articolo è stato tradotto con traduzione automatica, è possibile che contenga errori di vocabolario, sintassi o grammatica. L'articolo originale in Tedesco può essere trovato qui.
Pubblicazione originale
Michael Cangkrama, Huan Liu, Xiaoyu Wu, Josephine Yates, James Whipman, Christoph G. Gäbelein, Mai Matsushita, Luca Ferrarese, Sibilla Sander, Francesc Castro-Giner, Simran Asawa, Magdalena K. Sznurkowska, Manfred Kopf, Jörn Dengjel, Valentina Boeva, Nicola Aceto, Julia A. Vorholt, Sabine Werner; "MIRO2-mediated mitochondrial transfer from cancer cells induces cancer-associated fibroblast differentiation"; Nature Cancer, 2025-8-28







































