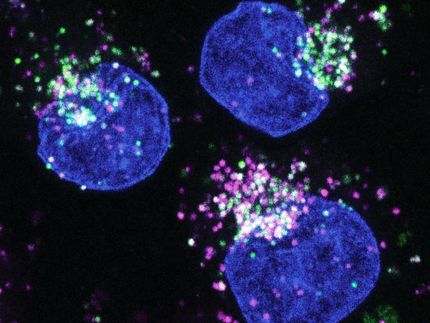
Uso de la entrega de ARNm para mejorar la fuerza muscular
Corrección selectiva de defectos genéticos
Las mutaciones que provocan atrofia muscular pueden repararse con el editor de genes CRISPR-Cas9. Un equipo dirigido por la investigadora del ECRC Helena Escobar ha introducido por primera vez esta herramienta en células madre musculares humanas utilizando ARNm, descubriendo así un método adecuado para aplicaciones terapéuticas.
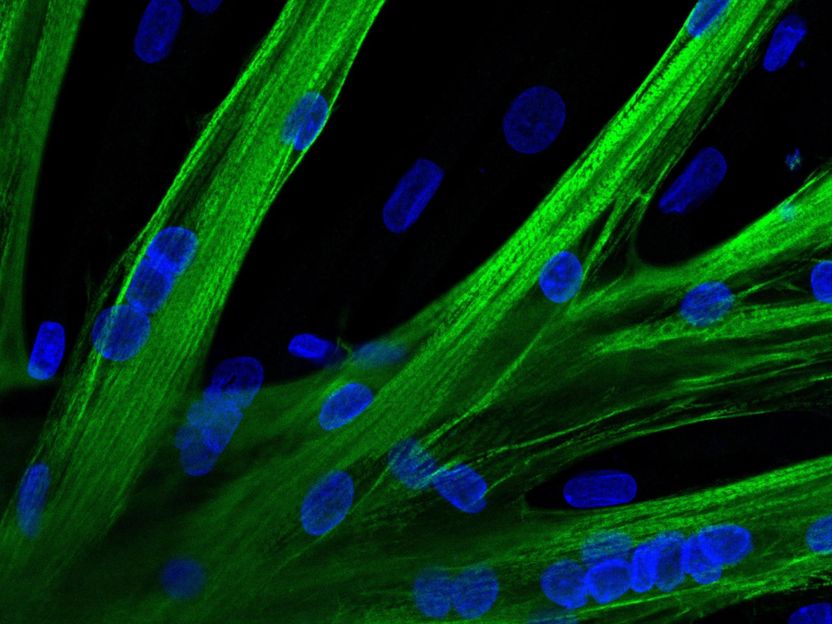
Los investigadores utilizaron ARNm para introducir el editor de genes CRISPR-Cas9 en células madre musculares humanas. Estas células se fusionaron en miotubos multinucleados tras la edición genética CRISPR-Cas9 mediada por ARNm. La cadena pesada de miosina se ve en verde y los núcleos en azul.
© Spuler Lab, MDC Berlin
Puede que sólo sea un cambio minúsculo en el genoma, pero esta pequeña diferencia puede tener consecuencias fatales: Las distrofias musculares están casi siempre causadas por un único gen defectuoso. Por muy diferentes que sean las mutaciones en este grupo de aproximadamente 50 trastornos, todas ellas conducen en última instancia a un resultado muy similar. "Debido al defecto genético, se producen cambios en la estructura y la función muscular, de modo que los afectados experimentan una atrofia muscular progresiva", explica la profesora Simone Spuler, jefa del Laboratorio de Miología del Centro de Investigación Experimental y Clínica (ECRC), una institución conjunta del Centro Max Delbrück de Medicina Molecular de la Asociación Helmholtz (MDC), con sede en Berlín, y la Charité - Universitätsmedizin Berlin. Esta enfermedad puede ser mortal, sobre todo si se ven afectados los músculos respiratorios o cardíacos.
El método ya ha dado buenos resultados en ratones
Las distrofias musculares son actualmente incurables, y eso es precisamente lo que Spuler y su equipo quieren cambiar. Su último artículo, que aparece en la revista Molecular Therapy Nucleic Acids, prepara el camino para un ensayo clínico en el que una terapia desarrollada en el ECRC se probará por primera vez en pacientes con atrofia muscular hereditaria. Llevamos varios años persiguiendo la idea de tomar células madre musculares de pacientes enfermos, utilizar CRISPR-Cas9 para corregir los genes defectuosos y, a continuación, inyectar las células tratadas de nuevo en los músculos para que puedan proliferar y formar nuevo tejido muscular", explica la Dra. Helena Escobar, investigadora postdoctoral en el laboratorio de Spuler y junto con su coautor del presente trabajo.
Hace un tiempo, los investigadores pudieron demostrar que el método funcionaba en ratones que sufrían atrofia muscular. "Sin embargo, nuestro método tenía una trampa", dice Escobar, explicando:. "Introdujimos las instrucciones genéticas del editor de genes en las células madre utilizando plásmidos, que son moléculas circulares de ADN de doble cadena derivadas de bacterias". Pero los plásmidos podrían integrarse involuntariamente en el genoma de las células humanas, que también es de doble cadena, y provocar entonces efectos indeseables difíciles de evaluar. "Eso hacía que este método no fuera adecuado para tratar a los pacientes", dice Escobar.
Corrección selectiva de defectos genéticos
Así que el equipo se propuso encontrar una alternativa mejor. La encontraron en forma de ARN mensajero (ARNm), una molécula de ARN monocatenario que recientemente ha sido aclamada como componente clave de dos vacunas Covid-19. "En las vacunas, las moléculas de ARNm contienen las instrucciones genéticas para construir la proteína pico del virus, que el patógeno utiliza para invadir las células humanas", explica Christian Stadelmann, estudiante de doctorado en el laboratorio de Spuler. Junto con Silvia Di Francescantonio, del mismo equipo, es uno de los coautores del estudio. "En nuestro trabajo utilizamos moléculas de ARNm que contienen las instrucciones de construcción de la herramienta de edición de genes".
Para introducir el ARNm en las células madre, los investigadores utilizaron un proceso llamado electroporación, que hace que las membranas celulares sean temporalmente más permeables a moléculas más grandes. "Con la ayuda de ARNm que contenía la información genética para un colorante verde fluorescente, demostramos primero que las moléculas de ARNm entraban en casi todas las células madre", explica Stadelmann. En el siguiente paso, el equipo utilizó una molécula deliberadamente alterada en la superficie de las células madre musculares humanas para demostrar que el método puede utilizarse para corregir defectos genéticos de forma selectiva.
Se está preparando un ensayo clínico
Por último, el equipo probó una herramienta similar al editor de genes CRISPR-Cas9 que no corta el ADN, sino que sólo lo retoca en un punto con precisión milimétrica. "Esto nos permite trabajar con una precisión aún mayor, aunque esta herramienta no es adecuada para todas las mutaciones que causan distrofia muscular", explica Stadelmann. En experimentos con placas de Petri, él y su equipo han podido demostrar que las células madre musculares corregidas son tan capaces como las sanas de fusionarse entre sí y formar fibras musculares jóvenes.
"Ahora estamos planeando lanzar un primer ensayo clínico con cinco o siete pacientes con distrofia muscular hacia finales de año", dice Spuler. El Instituto Federal de Vacunas y Biomedicina Paul-Ehrlich-Institut (PEI), responsable de aprobar el ensayo clínico, ha apoyado la idea en una reunión consultiva, añade. Por supuesto, no podemos esperar milagros, dice la investigadora, y añade: "Los enfermos que están en silla de ruedas no se levantarán y empezarán a caminar tras la terapia. Pero para muchos pacientes ya es un gran avance que un pequeño músculo importante para agarrar o tragar vuelva a funcionar mejor". La idea de reparar músculos más grandes, como los necesarios para estar de pie y caminar, ya se está estudiando". Sin embargo, para que esto se convierta en una terapia del mundo real, las herramientas moleculares tendrían que ser tan seguras que pudieran introducirse sin ninguna reserva, no sólo en células madre musculares aisladas, sino también directamente en el músculo degenerado.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.