Un nano-kit genético para la generación de nuevos biomateriales
Las bacterias magnéticas pronto podrían utilizarse para la producción de nuevos biomateriales. Un equipo de microbiólogos de la Universidad de Bayreuth dirigido por el Prof. Dr. Dirk Schüler desarrolló un sistema modular para la reprogramación genética de las bacterias, convirtiendo así los organismos en fábricas celulares de nanopartículas magnéticas multifuncionales que combinan varias funciones y propiedades útiles. Debido a sus excepcionales propiedades magnéticas y a su buena biocompatibilidad, estas nanopartículas podrían ser un nuevo material prometedor en el campo biomédico y biotecnológico.
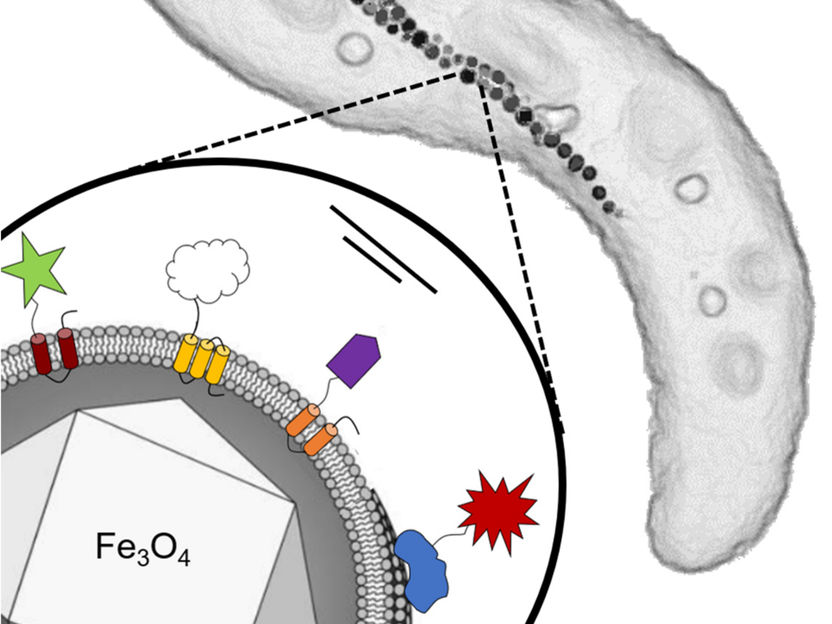
Arriba a la derecha: Esquema de una célula de la bacteria magnética Magnetospirillum gryphiswaldense utilizada en este estudio, mostrando su cadena intracelular de partículas magnetosomáticas. Cada célula tiene una longitud de entre tres y cinco micrómetros. Abajo a la izquierda: Un solo magnetosoma con un núcleo de óxido de hierro envuelto por una membrana. Diferentes grupos funcionales de organismos extraños se fusionaron genéticamente a proteínas específicas de la membrana del magnetosoma.
Frank Mickoleit / Clarissa Lanzloth
De los magnetosomas a las nanopartículas versátiles
Las bacterias magnéticas de la especie Magnetospirillum gryphiswaldense alinean su comportamiento de natación a lo largo del campo magnético de la Tierra. Dentro de las células, las nanopartículas magnéticas, los magnetosomas, están dispuestos en forma de cadena, formando así una aguja de brújula intracelular. Cada magnetosoma consiste en un núcleo magnético de óxido de hierro rodeado por una membrana. Además de lípidos, esta membrana también contiene una variedad de proteínas diferentes. Los microbiólogos de la Universidad de Bayreuth han logrado ahora acoplar a estas proteínas grupos funcionales bioquímicamente activos, que proceden de diversos organismos extraños. El método utilizado aquí comienza en la etapa de los genes que son responsables de la biosíntesis de las proteínas de la membrana. Estos genes bacterianos se fusionan con genes extraños de otros organismos que controlan la producción de las respectivas proteínas funcionales. Tan pronto como los genes se reintegran en el genoma, las bacterias reprogramadas producen magnetosomas que muestran estas proteínas extrañas instaladas permanentemente en la superficie de la partícula.
En el estudio, se acoplaron cuatro grupos funcionales diferentes (es decir, proteínas extrañas) a las proteínas de la membrana. Entre ellas se encuentra la enzima glucosa oxidasa de un hongo de moho, que ya se utiliza biotecnológicamente, por ejemplo como "sensor de azúcar" en las enfermedades de la diabetes. Además, se instalaron en la superficie de los magnetosomas una proteína verde fluorescente de una medusa y una enzima productora de colorante de la bacteria Escherichia coli, cuya actividad puede medirse fácilmente. El cuarto grupo funcional es un fragmento de anticuerpo de una lama (Alpaca) que se utilizó como un conector versátil. Así pues, todas estas propiedades, incluida la magnífica magnetización de los magnetosomas, están codificadas genéticamente en la bacteria.
"Usando esta estrategia genética, reprogramamos la bacteria para producir magnetosomas que brillan en verde cuando son irradiados con luz UV y al mismo tiempo muestran nuevas funciones biocatalíticas. Varias funciones bioquímicas pueden ser instaladas con precisión en sus superficies. De este modo, los magnetosomas de las bacterias vivas se transforman en nanopartículas multifuncionales con funciones y propiedades fascinantes. Además, las partículas siguen siendo plenamente funcionales cuando se aíslan de las bacterias, lo que puede realizarse fácilmente aprovechando sus propiedades magnéticas inherentes", dice el profesor Dirk Schüler, que dirigió el equipo de investigación.
Un conjunto de herramientas genéticas para aplicaciones en biomedicina y biotecnología
La funcionalización de los magnetosomas no se limita en absoluto a los grupos funcionales que fueron instalados en la superficie de las partículas por los microbiólogos de Bayreuth. En cambio, estas proteínas pueden ser fácilmente reemplazadas por otras funciones, proporcionando así una plataforma altamente versátil. Por lo tanto, la reprogramación genética abre un amplio espectro para diseñar la superficie del magnetosoma. Proporciona la base para un "juego de herramientas genéticas" que permite la producción de nanopartículas magnéticas adaptadas, combinando diferentes funciones y propiedades útiles. Cada una de estas partículas tiene un tamaño de entre tres y cinco nanómetros.
"Nuestro enfoque de ingeniería genética es altamente selectivo y preciso, comparado, por ejemplo, con las técnicas de acoplamiento químico que no son tan eficientes y carecen de este alto grado de control", explica el microbiólogo de Bayreuth, Dr. Frank Mickoleit, primer autor del estudio. Señala una ventaja decisiva de los nuevos biomateriales: "Estudios previos muestran que las nanopartículas magnéticas probablemente no son dañinas para los cultivos celulares. Una buena biocompatibilidad es un requisito importante para la futura aplicación de las partículas en biomedicina, por ejemplo como agentes de contraste en técnicas de imagen magnética o como sensores magnéticos en diagnósticos. En el futuro, por ejemplo, partículas similares podrían ayudar a detectar y destruir células tumorales. Los sistemas de biorreactores son otro campo de aplicación. Las nanopartículas magnéticas equipadas con catalizadores diminutos serían muy adecuadas para este fin y permitirían procesos bioquímicos complejos.
"Existe un enorme potencial de aplicación para las nanopartículas que muestran diferentes grupos funcionales en la superficie, particularmente en los campos de la biotecnología y la biomedicina. Las bacterias magnéticas pueden servir ahora como plataforma para un versátil nano-juego de herramientas, inspirando la creatividad científica en el campo de la biología sintética. Iniciará otros enfoques de investigación interesantes", añade la microbióloga Clarissa Lanzloth B.Sc., que participó en el nuevo estudio como coautora durante la realización de su tesis de maestría en "Bioquímica y Biología Molecular" en Bayreuth.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.





































