Cartilage artificiel grâce à l'impression 3D
Une nouvelle approche de la production de tissus artificiels utilise des cellules dans des microstructures issues de l'imprimante 3D
Est-il possible de cultiver des tissus en laboratoire, par exemple pour remplacer un cartilage endommagé ? La TU Wien (Vienne) a franchi une étape importante dans la création de tissus de remplacement en laboratoire, à l'aide d'une technique qui diffère considérablement des autres méthodes utilisées dans le monde.
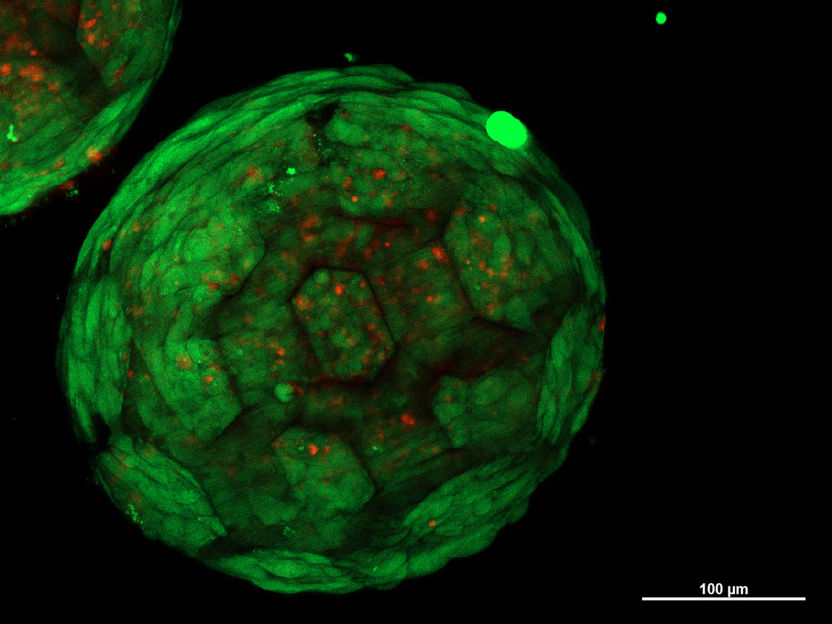
Un des sphéroïdes
TU Wien
Un processus spécial d'impression 3D à haute résolution est utilisé pour créer de minuscules sphères poreuses en plastique biocompatible et dégradable, qui sont ensuite colonisées par des cellules. Ces sphéroïdes peuvent ensuite être disposés selon n'importe quelle géométrie, et les cellules des différentes unités se combinent de manière transparente pour former un tissu vivant uniforme. Le tissu cartilagineux, avec lequel le concept a maintenant été démontré à l'Université de Vienne, était auparavant considéré comme particulièrement difficile à cet égard.
De minuscules cages sphériques servant d'échafaudage aux cellules
"La culture de cellules cartilagineuses à partir de cellules souches n'est pas le plus grand défi. Le principal problème est que l'on a généralement peu de contrôle sur la forme du tissu obtenu", explique Oliver Kopinski-Grünwald, de l'Institut de science et de technologie des matériaux de l'Université technique de Vienne, l'un des auteurs de l'étude actuelle. "Cela est également dû au fait que ces amas de cellules souches changent de forme au fil du temps et rétrécissent souvent.
Pour éviter cela, l'équipe de recherche de la TU Wien travaille avec une nouvelle approche : des systèmes d'impression 3D à haute résolution basés sur des lasers spécialement développés sont utilisés pour créer de minuscules structures en forme de cage qui ressemblent à des mini ballons de football et ont un diamètre d'à peine un tiers de millimètre. Elles servent de structure de soutien et forment des blocs de construction compacts qui peuvent ensuite être assemblés dans n'importe quelle forme.
Les cellules souches sont d'abord introduites dans ces mini-cages en forme de ballon de football, qui remplissent rapidement le minuscule volume. "De cette manière, nous pouvons produire de manière fiable des éléments tissulaires dans lesquels les cellules sont uniformément réparties et la densité cellulaire est très élevée. Cela n'aurait pas été possible avec les approches précédentes", explique le professeur Aleksandr Ovsianikov, chef du groupe de recherche sur l'impression 3D et la biofabrication à l'université de Vienne.
Une croissance parfaite
L'équipe a utilisé des cellules souches différenciées, c'est-à-dire des cellules souches qui ne peuvent plus se développer en n'importe quel type de tissu, mais qui sont déjà prédéterminées pour former un type de tissu spécifique, en l'occurrence le tissu cartilagineux. Ces cellules sont particulièrement intéressantes pour les applications médicales, mais la construction de tissus plus importants est un défi lorsqu'il s'agit de cellules cartilagineuses. Dans le tissu cartilagineux, les cellules forment une matrice extracellulaire très prononcée, une structure en forme de filet entre les cellules qui empêche souvent les différents sphéroïdes cellulaires de croître ensemble de la manière souhaitée.
Si les sphéroïdes poreux imprimés en 3D sont colonisés par des cellules de la manière souhaitée, les sphéroïdes peuvent prendre n'importe quelle forme. La question cruciale est maintenant de savoir si les cellules de différents sphéroïdes se combinent également pour former un tissu uniforme et homogène.
"C'est exactement ce que nous avons pu démontrer pour la première fois", explique Kopinski-Grünwald. "Au microscope, on voit très clairement que les sphéroïdes voisins se développent ensemble, que les cellules migrent d'un sphéroïde à l'autre et vice versa, qu'elles se connectent de manière transparente et qu'il en résulte une structure fermée sans aucune cavité - contrairement aux autres méthodes utilisées jusqu'à présent, dans lesquelles des interfaces visibles subsistent entre les amas de cellules voisins."
Les minuscules échafaudages imprimés en 3D confèrent à la structure globale une stabilité mécanique pendant que le tissu continue à mûrir. Au bout de quelques mois, les structures plastiques se dégradent, elles disparaissent tout simplement, laissant derrière elles le tissu fini dans la forme souhaitée.
Premier pas vers une application médicale
En principe, la nouvelle approche n'est pas limitée aux tissus cartilagineux, elle pourrait également être utilisée pour adapter différents types de tissus plus grands, tels que les tissus osseux. Toutefois, il reste encore quelques problèmes à résoudre : en effet, contrairement aux tissus cartilagineux, il faudrait également incorporer des vaisseaux sanguins dans ces tissus à partir d'une certaine taille.
"L'objectif initial serait de produire de petits morceaux de tissu cartilagineux sur mesure qui pourraient être insérés dans le tissu cartilagineux existant après une blessure", explique Oliver Kopinski-Grünwald. "Quoi qu'il en soit, nous avons pu démontrer que notre méthode de production de tissu cartilagineux à l'aide de microéchafaudages sphériques fonctionne en principe et présente des avantages décisifs par rapport à d'autres technologies.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.