Le métabolisme rencontre la signalisation pour ajuster la croissance cellulaire
Le métabolite endogène inhibe directement l'activité de mTORC1
Les cellules utilisent une variété de voies métaboliques pour synthétiser les éléments constitutifs de la croissance et de la prolifération. Pour assurer une croissance équilibrée, ces processus de biosynthèse doivent être étroitement coordonnés. Des chercheurs de l'Institut Max Planck de biologie du vieillissement, ainsi qu'une équipe de collaborateurs nationaux et internationaux, ont maintenant identifié une machinerie moléculaire qui détecte la capacité d'une cellule à produire des lipides, puis bloque ou active en conséquence tous les autres processus de biosynthèse, tels que la synthèse des protéines.
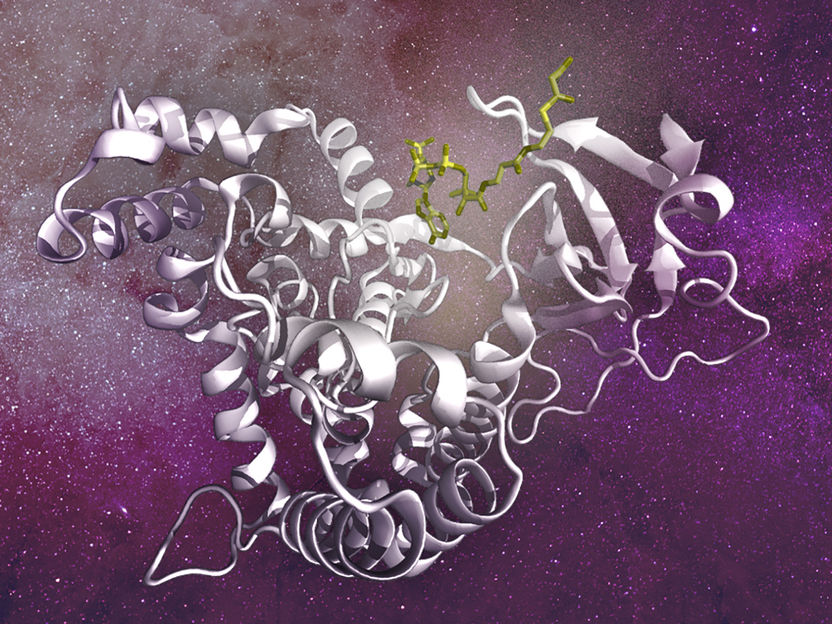
Le métabolite malonyl CoA se lie directement à la poche catalytique de mTOR et déplace l'ATP, un autre métabolite nécessaire à l'activité de mTOR.
©K. Link / Max Planck Institute for Biology of Ageing
Les cellules accumulent de la masse et se développent en utilisant des nutriments et de l'énergie pour construire des membranes, des protéines, des acides nucléiques et d'autres structures macromoléculaires, grâce à l'action coordonnée de diverses voies métaboliques. Par conséquent, les mécanismes de détection des nutriments garantissent que les cellules ne se développent que lorsque toutes les conditions sont optimales. Le capteur de nutriments le plus important dans les cellules est un complexe protéique appelé mTORC1. Lorsque les acides aminés, les éléments constitutifs des protéines, sont abondants, mTORC1 est actif et favorise la synthèse des protéines, reliant ainsi la disponibilité des acides aminés à la fonction cellulaire correspondante. Cependant, la manière dont la capacité des cellules à produire des lipides est détectée et le rôle joué par mTORC1 dans ce processus sont très mal compris.
Dans la biosynthèse des acides gras, l'acétyl-CoA, un métabolite provenant principalement de la dégradation du glucose (un autre nutriment important), est d'abord converti en malonyl-CoA par une enzyme appelée ACC1, qui est ensuite convertie en acides gras par une enzyme appelée FASN (synthase des acides gras). Les chercheurs ont montré que l'accumulation de malonyl-CoA, qui peut se produire lorsque les niveaux ou l'activité de la FASN sont faibles, conduit à l'inhibition de l'activité de mTORC1 et à la régulation à la baisse d'autres fonctions biosynthétiques régulées par mTORC1, telles que la synthèse des protéines. De manière surprenante, ils ont découvert que le malonyl-CoA se lie directement à la poche catalytique de mTOR, entrant en compétition avec l'ATP, un autre métabolite nécessaire pour que mTOR soit active et phosphoryle ses substrats.
"Ces résultats soulignent que le malonyl-CoA est le premier métabolite endogène décrit qui agit comme un inhibiteur compétitif de l'ATP pour une kinase de signalisation dans les cellules de mammifères", déclare Constantinos Demetriades, chef du groupe de recherche à l'Institut Max Planck pour la biologie du vieillissement et responsable de l'étude. "Il est intéressant de noter que ce phénomène est conservé au cours de l'évolution, de la levure aux cellules humaines, et qu'il représente donc un mécanisme ancien par lequel le métabolisme des lipides communique avec le régulateur central de tous les autres processus métaboliques, mTORC1".
Lien entre la biosynthèse des acides gras et la croissance cellulaire par l'intermédiaire de mTORC1
Au niveau moléculaire, les chercheurs ont découvert que mTORC1 forme des interactions physiques avec ACC1 et FASN, ce qui lui permet de détecter directement les niveaux de malonyl-CoA sur le site de production du métabolite. Ainsi, la liaison directe du malonyl-CoA à mTORC1 désactive tous les autres processus cellulaires contrôlés en aval de ce complexe. Par conséquent, dans des conditions où une cellule ne peut pas produire suffisamment d'acides gras, l'inhibition de mTORC1 bloquerait également la synthèse des protéines, d'autres processus anaboliques et, finalement, la croissance cellulaire, jusqu'à ce que les conditions soient à nouveau optimales.
Étant donné que les inhibiteurs pharmacologiques de FASN, comme ceux utilisés dans cette étude, sont utilisés comme médicaments anticancéreux en clinique, ces découvertes pourraient également être pertinentes pour le traitement du cancer à l'avenir. D'après les données décrites ici, les inhibiteurs de FASN ont probablement un double effet sur les cellules cancéreuses : non seulement ils bloquent la synthèse des acides gras, qui est nécessaire à la formation des membranes et à la production d'énergie, mais ils inhibent également l'activité de mTORC1, qui est dérégulée dans la plupart des cancers.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.
Publication originale
Raffaele Nicastro, Laura Brohée, Josephine Alba, Julian Nüchel, Gianluca Figlia, Stefanie Kipschull, Peter Gollwitzer, Jesus Romero-Pozuelo, Stephanie A. Fernandes, Andreas Lamprakis, Stefano Vanni, Aurelio A. Telemann, Claudio De Virgilio, Constantinos Demetriades; "Malonyl-CoA is a conserved endogenous ATP-competitive mTORC1 inhibitor"; Nature Cell Biology.



































