Comment les défenses de l'organisme gardent leurs armes en échec
Protection contre les infections mortelles
Les molécules de signalisation du système immunitaire ne doivent déclencher une réponse que lorsque cela est nécessaire. Pour éviter une propagation potentiellement mortelle au reste du corps, le tissu conjonctif peut absorber ces molécules comme une éponge. Une équipe dirigée par Thomas Blankenstein présente ce mécanisme dans "Nature Immunology".
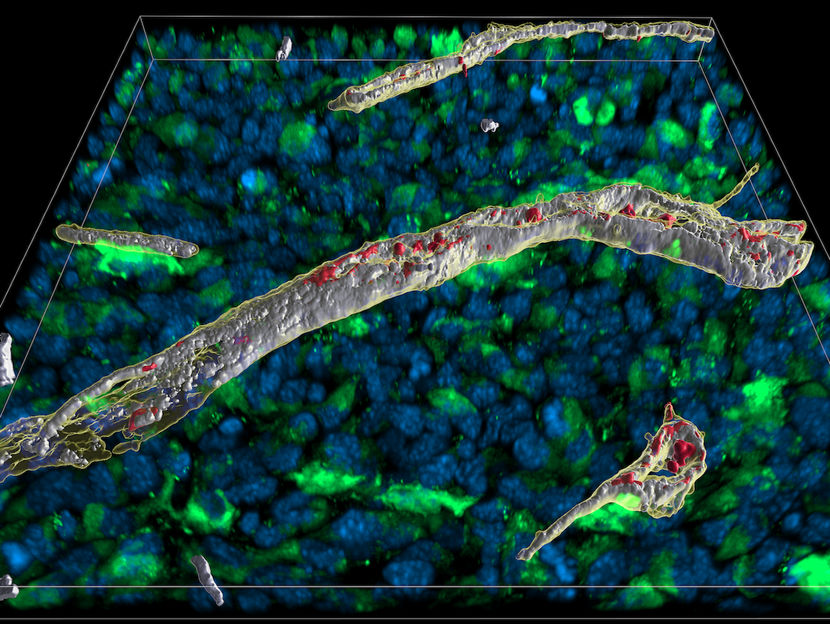
Analyse microscopique d'une coupe de 16µm d'épaisseur à travers un tissu dans lequel le messager immunitaire interféron gamma a été libéré : Les zones du vaisseau sanguin où l'interféron et l'héparane sulfate se lient l'un à l'autre sont visibles spatialement en blanc.
AG Blankenstein, Max Delbrück Center
Lorsque les cellules T du système immunitaire communiquent, elles le font à l'aide de cytokines. Un membre important de la famille des cytokines est l'interféron-gamma - une protéine qui active les défenses de l'organisme, notamment dans la lutte contre les virus et les bactéries intracellulaires. Au cours de l'évolution, le corps humain a mis au point diverses stratégies pour empêcher la réponse immunitaire de dépasser son objectif. Un autre mécanisme important vient d'être découvert par une équipe de recherche franco-allemande dirigée par le professeur Thomas Blankenstein, chef du laboratoire d'immunologie moléculaire et de thérapie génique du centre Max Delbrück de Berlin.
Tout repose sur quatre acides aminés seulement
Dans un article publié dans la revue Nature Immunology, les scientifiques expliquent comment l'interféron-gamma utilise quatre acides aminés pour se lier à la matrice extracellulaire du tissu conjonctif, qui forme un réseau entre les cellules individuelles et assure ainsi le contact intercellulaire. Le premier auteur de l'étude, le Dr Josephine Kemna, explique que cette liaison empêche la cytokine de se répandre dans tout l'organisme et de déclencher des réponses immunitaires dangereuses. Selon elle, lorsque les acides aminés nécessaires à la liaison font défaut, les défenses de l'organisme s'en trouvent gravement affaiblies. Kemna a été membre de l'équipe de Blankenstein de 2017 à 2022. L'année dernière, elle a rejoint la société de biotechnologie berlinoise T-knife Therapeutics - une spin-off du laboratoire de Blankenstein. Kemna a terminé son doctorat avec cette dernière étude, dans laquelle la Charité - Universitätsmedizin Berlin a également joué un rôle clé. La recherche a été soutenue par une subvention de la Fondation Wilhelm Sander.
Le point de départ de l'étude a été une observation faite par Blankenstein et son équipe il y a quelques années : "Nous avons remarqué que la structure moléculaire de la cytokine interféron-gamma diffère fortement d'une espèce à l'autre", explique le Dr Thomas Kammertöns, un autre membre de l'équipe qui travaille également à l'Institut d'immunologie de la Charité. Il a supervisé la thèse de doctorat de Kemna avec Blankenstein et figure en tant que dernier auteur. "Cependant, une courte séquence de quatre acides aminés, connue sous le nom de motif KRKR, est restée pratiquement inchangée tout au long de l'évolution des vertébrés - c'est-à-dire pendant plus de 450 millions d'années - dans les 50 espèces que nous avons étudiées." Sur la base de cette découverte, l'équipe a déduit que le motif KRKR doit jouer un rôle important dans la fonction de la cytokine - et a décidé de tester cette hypothèse.
Une cytokine qui devient rapidement toxique dans le sang
Les chercheurs ont commencé par utiliser un modèle de souris mis au point par Kammertöns, qui leur a permis de réguler la concentration d'interféron-gamma produit. "Ce modèle nous a déjà permis de déterminer que l'interféron-gamma devient très rapidement toxique et que les animaux présentant des concentrations élevées de cette molécule de signalisation dans leur sang tombent malades en quelques jours", explique Kammertöns. Les analyses biochimiques ont également révélé qu'une fois que la protéine est sécrétée par les cellules T avec ses quatre acides aminés chargés positivement, elle se lie à la matrice extracellulaire chargée négativement, à savoir à la molécule d'héparane sulfate.
"Cela permet de retenir l'interféron gamma localement et d'éviter qu'il ne se répande dans l'organisme", explique M. Kammertöns. Toutefois, étant donné que la structure de l'héparane sulfate diffère selon le tissu, le type de cellule ou même l'état cellulaire, la capacité du tissu conjonctif à fixer l'interféron-gamma peut également varier, ajoute le professeur Hugues Lortat-Jacob de l'Université Grenoble-Alpes, qui a également participé à l'étude.
Pour l'étape suivante, le groupe s'est tourné vers le Dr Ralf Kühn, responsable du Genome Editing & Disease Models Lab au Centre Max Delbrück, pour l'aider à développer un modèle qui produirait des molécules d'interféron sans motif KRKR. Pour ce faire, Kühn et son équipe ont retiré les quatre acides aminés de la cytokine chez des souris en utilisant la technique d'édition de gènes CRISPR-Cas9. "Pendant longtemps, les scientifiques ont cru que la molécule de signalisation dépendait de ce site de liaison pour fonctionner", explique Kammertöns. "Nous devions donc d'abord prouver que ce n'est pas le cas". Et l'équipe a effectivement pu montrer que, même sans le motif KRKR, l'interféron-gamma se fixe toujours à son récepteur à la surface des cellules et joue son rôle habituel dans la réponse immunitaire.
Des mécanismes de défense très puissants
Normalement, le système immunitaire combat ensuite l'infection virale et finit par l'éliminer. Cependant, ce n'était pas le cas pour les souris dont l'interféron-gamma était dépourvu des quatre acides aminés. "Le système immunitaire des animaux était encore capable de réguler les réponses immunitaires pour les virus qui ne provoquent que de très brèves réactions inflammatoires", rapporte Kammertöns, précisant que dans ces cas, la quantité d'interféron-gamma dans le sang augmentait initialement, mais retombait ensuite très rapidement. "Pourtant, lorsque les souris ont été infectées par des virus LCM, qui provoquent une maladie semblable à la grippe appelée chorioméningite lymphocytaire et qui occupent le système immunitaire pendant une période plus longue, les souris génétiquement modifiées sont rapidement tombées malades en raison des concentrations élevées d'interféron-gamma dans leur sang."
"Selon moi, il ressort clairement de nos recherches que notre système immunitaire a développé des mécanismes très puissants pour garder ses propres défenses sous contrôle, explique le premier auteur Kemna. Si ces mécanismes ne fonctionnent pas correctement, dit-elle, le système immunitaire peut finir par endommager son propre organisme en raison de l'effet toxique de certaines molécules qui continuent à se propager. "Le mécanisme que nous avons découvert montre que l'évolution a fait en sorte que les molécules toxiques n'agissent généralement que là où elles sont nécessaires, c'est-à-dire là où la cellule T reconnaît une cellule infectée par un virus."
Protection contre une infection mortelle
"Cette étude est d'une importance fondamentale pour l'immunologie et notre compréhension de nombreuses maladies inflammatoires dans le corps humain", déclare Kammertöns. Il explique également que la matrice extracellulaire a une structure différente chez les hommes et les femmes, de sorte que le mécanisme nouvellement découvert pourrait expliquer pourquoi certaines maladies infectieuses et auto-immunes évoluent si différemment chez les hommes et les femmes. "Nous n'aurions jamais pu faire ces nouvelles découvertes sans la collaboration exceptionnelle avec notre collègue français Hugues Lortat-Jacob, qui mène des recherches sur les matrices extracellulaires depuis plus de 30 ans et qui est l'un des plus grands experts mondiaux dans ce domaine", ajoute M. Kammertöns.
Kammertöns planifie maintenant la prochaine phase de l'étude avec le chef de son groupe, Blankenstein, et des scientifiques du centre médical universitaire de Fribourg. Ensemble, ils vont tester leurs dernières découvertes sur un nouveau modèle. Nous voulons travailler avec des souris dites "sauvages", c'est-à-dire des souris qui ont déjà subi plusieurs infections et dont le système immunitaire suscite donc une réponse plus proche de celle de l'homme", explique Kammertöns.
"Au cours de son évolution, le système immunitaire a développé des armes de plus en plus puissantes dans une sorte de course aux armements contre les agents pathogènes", résume Blankenstein. "Nos travaux ont permis de découvrir un nouveau mécanisme qui agit comme un contrepoids à cet arsenal d'armes sans réduire l'efficacité de la réponse immunitaire - quatre acides aminés seulement de l'interféron-gamma empêchent les maladies infectieuses de causer beaucoup plus de décès." Il est donc logique, à l'avenir, de mieux comprendre les détails exacts de l'interaction entre l'interféron-gamma et la matrice extracellulaire.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.