Cómo las defensas del organismo mantienen sus armas a raya
Protección contra infecciones mortales
Las moléculas señalizadoras del sistema inmunitario deben desencadenar una respuesta sólo cuando sea necesario. Para evitar una propagación potencialmente mortal al resto del organismo, el tejido conjuntivo puede absorber estas moléculas como una esponja. Un equipo dirigido por Thomas Blankenstein presenta este mecanismo en "Nature Immunology".
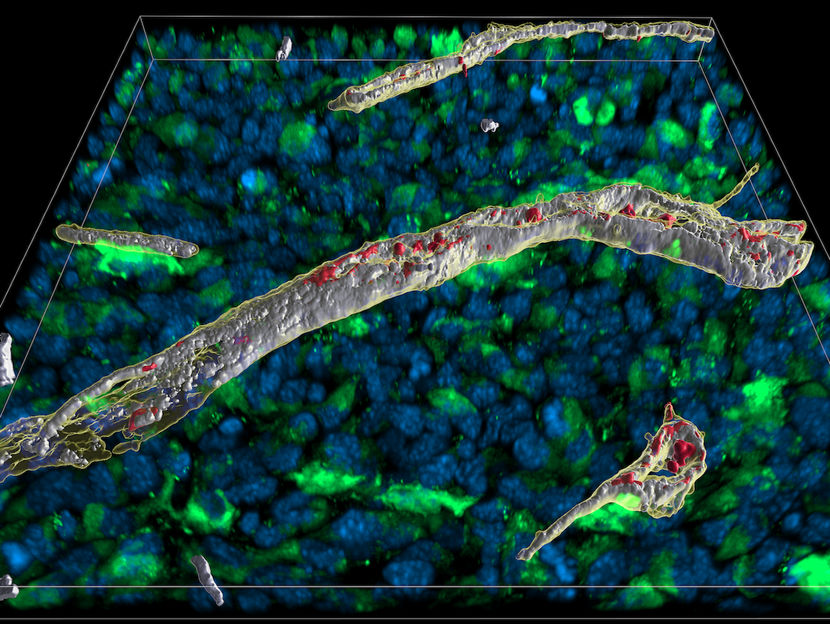
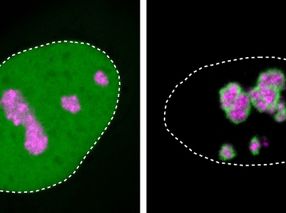
Análisis microscópico de una sección de 16 µm de grosor a través de un tejido en el que se ha liberado el mensajero inmunitario interferón gamma: Las zonas del vaso sanguíneo donde el interferón y el heparán sulfato se unen pueden verse espacialmente en blanco.
AG Blankenstein, Max Delbrück Center
Cuando las células T del sistema inmunitario se comunican, lo hacen con la ayuda de citocinas. Un miembro importante de la familia de las citocinas es el interferón-gamma, una proteína que activa las defensas del organismo, sobre todo en la lucha contra virus y bacterias intracelulares. A lo largo de la evolución, el cuerpo humano ha desarrollado diversas estrategias para evitar que la respuesta inmunitaria se exceda. Ahora, un equipo de investigación germano-francés dirigido por el profesor Thomas Blankenstein, jefe del Laboratorio de Inmunología Molecular y Terapia Génica del Centro Max Delbrück de Berlín, ha descubierto otro importante mecanismo.
Todo depende de sólo cuatro aminoácidos
En un artículo publicado en la revista Nature Immunology, los científicos explican cómo el interferón gamma utiliza cuatro aminoácidos para unirse a la matriz extracelular del tejido conjuntivo, que forma una red entre las células individuales y media así el contacto intercelular. La Dra. Josephine Kemna, primera autora del estudio, explica que esta unión impide que la citocina se extienda por todo el cuerpo y desencadene respuestas inmunitarias peligrosas. Cuando faltan los aminoácidos necesarios para la unión, dice, el resultado es un grave deterioro de las defensas del organismo. Kemna formó parte del equipo de Blankenstein de 2017 a 2022. El año pasado se trasladó a la empresa biotecnológica berlinesa T-knife Therapeutics, una empresa derivada del laboratorio de Blankenstein. Kemna completó su doctorado con este último estudio, en el que Charité - Universitätsmedizin Berlin también desempeñó un papel clave. La investigación contó con una subvención de la Fundación Wilhelm Sander.
El punto de partida del estudio fue una observación realizada por Blankenstein y su equipo hace unos años: "Nos dimos cuenta de que la estructura molecular de la citocina interferón-gamma difiere mucho de una especie a otra", explica el Dr. Thomas Kammertöns, otro miembro del equipo que también trabaja en el Instituto de Inmunología de Charité. Dirigió la tesis doctoral de Kemna junto con Blankenstein y figura como último autor. "Sin embargo, una breve secuencia de cuatro aminoácidos, conocida como motivo KRKR, ha permanecido prácticamente inalterada a lo largo de toda la evolución de los vertebrados -es decir, más de 450 millones de años- en las 50 especies que estudiamos." Basándose en este hallazgo, el equipo dedujo que el motivo KRKR debe desempeñar un papel importante en la función de la citocina - y decidió poner a prueba esta hipótesis.
Se vuelve rápidamente tóxica en la sangre
Los investigadores empezaron utilizando un modelo de ratón desarrollado por Kammertöns, que les permitía regular la concentración de interferón-gamma que se producía. "A partir de este modelo ya pudimos determinar que el interferón-gamma se vuelve tóxico muy rápidamente, y que los animales con altas concentraciones de esta molécula señalizadora en la sangre enferman a los pocos días", explica Kammertöns. Los análisis bioquímicos también revelaron que, una vez segregada la proteína a través de las células T con sus cuatro aminoácidos cargados positivamente, se une a la matriz extracelular cargada negativamente, es decir, a la molécula heparán sulfato.
"Esto garantiza que el interferón gamma se retenga localmente y evita que se extienda por todo el cuerpo", explica Kammertöns. Sin embargo, dado que la estructura del heparán sulfato difiere según el tejido, el tipo de célula o incluso el estado celular, la capacidad del tejido conjuntivo para retener el interferón gamma también puede variar, añade el profesor Hugues Lortat-Jacob, de la Universidad Grenoble-Alpes, que también participó en el estudio.
En el siguiente paso, el grupo recurrió al Dr. Ralf Kühn, jefe del Laboratorio de Edición Genómica y Modelos de Enfermedad del Centro Max Delbrück, para que les ayudara a desarrollar un modelo que produjera moléculas de interferón sin el motivo KRKR. Para ello, Kühn y su equipo eliminaron los cuatro aminoácidos de la citocina en ratones mediante la técnica de edición genética CRISPR-Cas9. "Durante mucho tiempo, los científicos han creído que la molécula de señalización dependía de este sitio de unión para funcionar", explica Kammertöns. "Así que primero tuvimos que demostrar que no es así". Y, efectivamente, el equipo pudo demostrar que, incluso sin el motivo KRKR, el interferón-gamma sigue uniéndose a su receptor en la superficie de las células y desempeña su función habitual en la respuesta inmunitaria.
Mecanismos de defensa muy potentes
Normalmente, el sistema inmunitario combatiría la infección vírica y acabaría eliminándola. Sin embargo, en el caso de los ratones que carecían de los cuatro aminoácidos en su interferón-gamma, no fue así. "El sistema inmunitario de los animales seguía siendo capaz de regular las respuestas inmunitarias a los virus que sólo provocaban reacciones inflamatorias muy breves", explica Kammertöns, quien añade que, en estos casos, la cantidad de interferón-gamma en la sangre aumentaba al principio, pero volvía a disminuir muy rápidamente. "Sin embargo, cuando los ratones fueron infectados con virus LCM, que causan una enfermedad parecida a la gripe llamada coriomeningitis linfocítica y mantienen ocupado al sistema inmune durante un período de tiempo más largo, los ratones editados genéticamente enfermaron rápidamente debido a las altas concentraciones de interferón-gamma en su sangre."
"En mi opinión, de nuestra investigación se desprende claramente que nuestro sistema inmunitario ha desarrollado mecanismos muy potentes para mantener bajo control sus propias defensas", afirma el primer autor, Kemna. Si estos mecanismos no funcionan correctamente, afirma, el sistema inmunitario puede acabar dañando a su propio organismo debido al efecto tóxico de ciertas moléculas a medida que siguen propagándose. "El mecanismo que hemos descubierto demuestra que la evolución se ha asegurado de que las moléculas tóxicas actúen generalmente sólo donde son necesarias, es decir, donde la célula T reconoce una célula infectada por el virus".
Protección contra la infección mortal
"Este estudio tiene una importancia fundamental para la inmunología y nuestra comprensión de muchas enfermedades inflamatorias del cuerpo humano", afirma Kammertöns. También explica que la matriz extracelular tiene una estructura diferente en hombres y mujeres, por lo que el mecanismo recién descubierto podría explicar por qué algunas enfermedades infecciosas y autoinmunes progresan de forma tan diferente en hombres y mujeres. "Nunca habríamos hecho estos nuevos descubrimientos sin la extraordinaria colaboración con nuestro colega francés Hugues Lortat-Jacob, que lleva más de 30 años investigando las matrices extracelulares y es uno de los mayores expertos mundiales en este campo", añade Kammertöns.
Kammertöns planea ahora la siguiente fase del estudio con el jefe de su grupo, Blankenstein, y científicos del Centro Médico Universitario de Friburgo. Juntos van a probar sus últimos hallazgos en un nuevo modelo. "Queremos trabajar con los llamados ratones salvajes, es decir, ratones que ya han sufrido varias infecciones y cuyo sistema inmunitario, por tanto, provoca una respuesta más parecida a la humana", explica Kammertöns.
"A lo largo de su evolución, el sistema inmunitario ha desarrollado armas cada vez más potentes en una especie de carrera armamentística contra los patógenos", resume Blankenstein. "Nuestro trabajo ha descubierto un nuevo mecanismo que actúa como contrapeso a este arsenal de armas sin reducir la eficacia de la respuesta inmunitaria: sólo cuatro aminoácidos del interferón-gamma impiden que las enfermedades infecciosas causen muchas más muertes". Por tanto, en el futuro tiene sentido comprender mejor los detalles exactos de la interacción entre el interferón-gamma y la matriz extracelular.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.