El estudio de los cristales puede resolver el misterio del ADN
El laboratorio de Rice capta detalles inéditos de la replicación y da pistas sobre cómo se producen las mutaciones
Cuando las células se reproducen, los mecanismos internos que copian el ADN lo hacen bien casi siempre. Los biocientíficos de la Universidad de Rice han descubierto un pequeño detalle que ayuda a entender cómo puede salir mal el proceso.
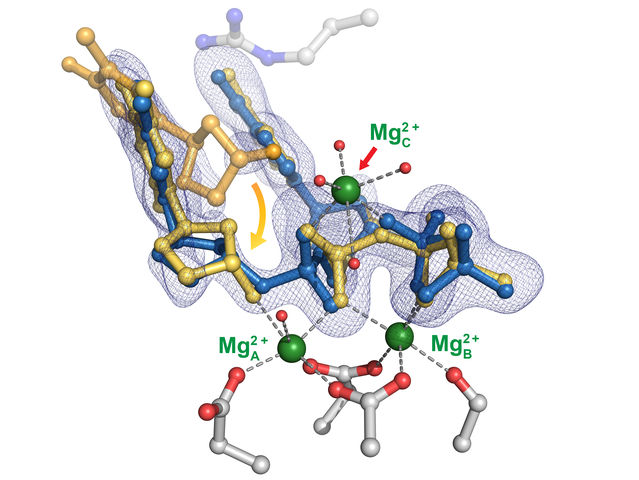
La estructura de la poli-eta, una enzima que ayuda a dirigir la replicación del ADN. Un estudio de cristalografía con resolución temporal de la enzima realizado en la Universidad de Rice descubrió la importancia de un tercer ion metálico que ayuda a estabilizar el proceso, garantizando su precisión.
Yang Gao Lab/Rice University
Su estudio de las enzimas ha revelado que la presencia de un ion metálico central, fundamental para la replicación del ADN, también parece estar implicada en la mala incorporación, es decir, en el ordenamiento defectuoso de los nucleótidos en las nuevas cadenas.
La observación publicada en Nature Communications podría ayudar a encontrar tratamientos para las mutaciones genéticas y las enfermedades que causan, incluido el cáncer.
El biólogo estructural de Rice Yang Gao, el estudiante de posgrado Caleb Chang y la ex alumna Christie Lee Luo utilizaron la cristalografía con resolución temporal para analizar las enzimas flexibles denominadas polimerasas cuando se doblan y retuercen para reensamblar rápidamente cadenas completas de ADN a partir de un conjunto de nucleótidos C, G, A y T.
Todas las proteínas que intervienen en la replicación del ADN dependen de los iones metálicos -magnesio o manganeso- para catalizar la transferencia de los nucleótidos a sus posiciones adecuadas a lo largo de la hebra, pero hace tiempo que se debate si son dos o tres los iones implicados.
El equipo de Rice parece haberlo resuelto mediante el estudio de una polimerasa conocida como eta, una enzima de síntesis de translesiones que protege contra las lesiones inducidas por los rayos ultravioleta. Según los investigadores, las personas con mutaciones en el gen de la polimerasa suelen tener una predisposición al xeroderma pigmentoso y al cáncer de piel.
Gao dijo que las polimerasas típicas se asemejan a una forma diestra, y piensa en ellas en términos de una mano real: "Tienen un dominio de la palma de la mano que sostiene el sitio activo, un dominio de los dedos que se cierra para interactuar con el nuevo par de bases y un dominio del pulgar que se une al ADN cebador/plantilla", dijo.
Pero hasta ahora, los científicos sólo podían adivinar algunos detalles del mecanismo bien oculto por el que las polimerasas hacen su trabajo, y ocasionalmente fallan. El tipo de cristalografía con resolución temporal utilizado en el laboratorio de Gao permitió a los investigadores analizar las proteínas cristalizadas en 34 etapas intermedias para definir las posiciones de sus átomos antes, durante y después de la síntesis del ADN.
"Esta reacción cinética es difícil de captar porque hay muchos átomos y trabajan muy rápido", dijo Gao, profesor asistente de biociencias que se unió a Rice como becario CPRIT en 2019. "Nunca hemos sabido cómo se mueven los átomos juntos porque faltaba la información espacial. Congelar las proteínas y un sustrato de molécula pequeña nos permite capturar esta reacción catalítica por primera vez."
El estudio les llevó a la teoría de que el primero de los tres átomos metálicos de eta favorece la unión del nucleótido, y el segundo es la clave para mantener el nucleótido y el cebador en el camino al estabilizar la unión de los nucleótidos sueltos al cebador situado en la mitad existente de la nueva hebra (también conocida como sustrato). Los cebadores son hebras cortas de ADN que marcan el lugar donde las polimerasas comienzan a encadenar nuevos nucleótidos.
"Sólo cuando los dos primeros iones metálicos están controlados, puede venir el tercero e impulsar la reacción", dijo Chang, sugiriendo que el proceso puede ser universal entre las polimerasas.
Los investigadores también observaron que la poli-eta contiene un motivo que la hace propensa a la desalineación de los cebadores, lo que conlleva una mayor probabilidad de incorporación errónea.
"Se trata, en primer lugar, de un mecanismo básico de la vida", dijo Gao. "El ADN tiene que copiarse con precisión, y los errores pueden dar lugar a enfermedades humanas. Las personas que estudian estas enzimas saben que para la síntesis del ADN, siempre lo hacen mucho, mucho mejor de lo que deberían porque hay una cantidad muy limitada de energía disponible para que elijan el par de bases correcto."
Para Gao, el verdadero avance está en demostrar la capacidad de la cristalografía con resolución temporal para observar todo un proceso catalítico con detalle atómico.
"Esto nos permite ver exactamente lo que ocurre en un proceso catalítico dinámico a lo largo del tiempo", dijo.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.