Por primera vez, el ADN y las proteínas detectadas por nanoporos diseñados de novo
Este logro podría aplicarse para facilitar la comprensión de la relación entre la estructura y la función de las proteínas
Investigadores japoneses han diseñado los primeros péptidos de diseño ascendente, compuestos por cadenas de aminoácidos, que pueden formar nanoporos artificiales para identificar y permitir la clasificación de una sola molécula de material genético en una membrana lipídica.

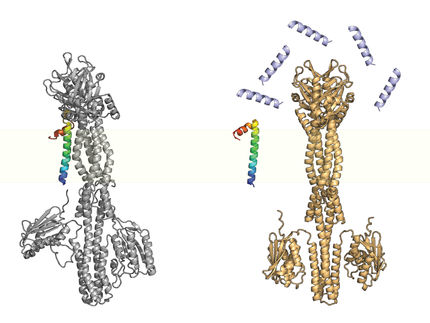
Diseño de novo de un nanoporo para la detección de una sola molécula que incorpora un péptido β-hairpin
Ryuji Kawano, Tokyo University of Agriculture and Technology
Los nanoporos biológicos suelen ser canales formados por proteínas que forman poros, que pueden detectar moléculas específicas, pero estos canales naturales son difíciles de identificar, lo que limita las aplicaciones propuestas en la secuenciación de ADN de bajo coste y rápida, la detección de moléculas pequeñas y otras.
"La detección por nanoporos es una poderosa herramienta para la detección de moléculas individuales sin etiquetas", afirma el autor correspondiente, Ryuji Kawano, profesor de la Universidad de Agricultura y Tecnología de Tokio (TUAT), en Japón. "Es la primera vez que se detectan ADN y polipéptidos mediante un nanoporo diseñado de novo".
Los nanoporos diseñados de novo se construyen "desde cero", según Kawano, y tienen el potencial de imitar las proteínas naturales y su capacidad para detectar proteínas específicas. Kawano afirma que también pueden diseñarse para que actúen como máquinas moleculares artificiales capaces de detectar una gama mucho más amplia de moléculas, lo que podría ayudar a dilucidar la conexión entre la estructura y la función de las proteínas objetivo.
"La estructura plegada de las proteínas viene determinada por su secuencia polipeptídica lineal y da lugar a una funcionalidad proteica específica", explicó Kawano, quien señaló que todas las proteínas tienen una estructura y un tamaño únicos. "La estructura primaria única es el resultado de la evolución estructural, como la mutación y selección de residuos de aminoácidos a lo largo del tiempo. Revelar la relación entre esta información primaria y la estructura de las proteínas es uno de los objetivos últimos de la ciencia".
Para desarrollar grandes nanoporos sintéticos que puedan detectar e identificar mejor las moléculas para aplicaciones prácticas, Kawano y el equipo diseñaron un péptido denominado SV28. Con dos brazos de aminoácidos doblados en un ángulo agudo y cargas específicas en el extremo, la orientación del péptido en forma de horquilla puede controlarse con precisión aplicando un voltaje. El péptido puede ensamblarse para formar estructuras de nanoporos de entre 1,7 y 6,3 nanómetros, adecuadas para detectar moléculas de ADN.
Los investigadores también modificaron el SV28 añadiendo una mutación que hace que la estructura del péptido se doble y retuerza de forma específica. El péptido resultante formó poros uniformemente dispersos de 1,7 nanómetros cada uno, capaces de detectar una sola cadena polipeptídica -o la mitad de una proteína-.
Este logro podría aplicarse para facilitar la comprensión de la relación entre la estructura y la función de las proteínas.
Para los próximos pasos, el equipo tiene previsto diseñar varios péptidos y proteínas para construir diferentes tipos de nanoporos que ayuden a la secuenciación de péptidos, funcionen como robots moleculares, etc.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.