¿Cómo comienza la enfermedad de Alzheimer?
Cómo se descontrola el equilibrio del calcio
La enfermedad de Alzheimer es una de las enfermedades más complejas y prolongadas del cerebro humano. Especialmente el inicio de la enfermedad resulta extremadamente difícil de estudiar. Se produce entre 15 y 30 años antes de que los pacientes se hagan clínicamente visibles debido a los déficits cognitivos, especialmente en las áreas del lenguaje y la memoria. Se sabe que un equilibrio de calcio alterado en las neuronas está presente al principio de la enfermedad de Alzheimer y probablemente contribuye a los primeros fallos de memoria. El profesor Martin Korte y su equipo de la Universidad Técnica de Braunschweig han demostrado en un estudio cómo se descontrola el equilibrio del calcio. Los resultados acaban de publicarse en la revista "PNAS".
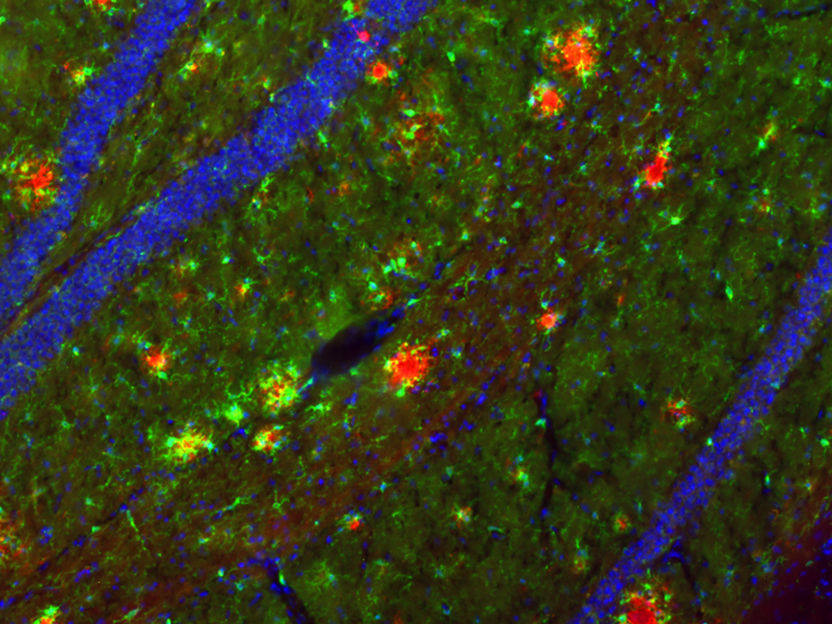
Los depósitos de Aβ se han visualizado en rojo en el hipocampo del ratón. Para poder examinar estos depósitos típicos del Alzheimer en el ratón, se necesitan modelos de ratón especiales.
Holz, Korte/TU Braunschweig
Lo característico de la enfermedad de Alzheimer son las placas, depósitos de proteínas fuera de las células nerviosas del cerebro. Estas placas están formadas por una aglomeración de fragmentos de proteína que consiste en el famoso amiloide ß (Aß). ¿Pero cómo se forma esta molécula? Se corta a partir de una proteína precursora en un complejo proceso de dos pasos. Pero eso no es todo: a partir de esta proteína precursora -llamémosla educadamente por su nombre completo: proteína precursora del amiloide (APP)- hay también dos moléculas hermanas (también conocidas como homólogas), a las que sólo les quedaban los números para darles sus nombres: APLP1 y APLP2.
En un estudio reciente, el profesor Dr. Martin Korte, junto con la Dra. Susann Ludewig y otros miembros de su equipo de la Universidad Técnica de Braunschweig, pudo identificar un mecanismo de cómo la proteína precursora del amiloide (APP), sus productos de escisión y su homóloga (APLP2) controlan las corrientes de calcio neuronales. Y no es el Aß el que desempeña un papel aquí, sino otro producto de escisión natural del APP: el APPsalfa secretado (APPsα) es, según las conclusiones del estudio, un regulador esencial del equilibrio del calcio celular.
Calcio: importante para la transmisión de señales en el cerebro
El calcio desempeña un papel fundamental tanto para el mantenimiento del equilibrio (homeostático) como para los cambios funcionales de las neuronas mediante la alteración de la actividad neuronal (llamada plasticidad), ya que media y controla las cascadas de señalización enzimática hasta la transcripción de genes. La hipótesis, que según los neurocientíficos de la Universidad Técnica de Braunschweig se ve reforzada por los nuevos hallazgos, es que el equilibrio del calcio en la enfermedad de Alzheimer, así como la dinámica del calcio, ya están alterados en el inicio temprano de la enfermedad.
Desequilibrio en detrimento del regulador del calcio
Este desequilibrio está provocado por un aumento de la escisión del APP -posiblemente debido al envejecimiento o a procesos inflamatorios crónicos- en la llamada "vía de señalización amiloidógena" hacia el Aß, es decir, hacia los fragmentos de proteína responsables de las famosas placas extracelulares asociadas al Alzheimer. Este mecanismo está a expensas del regulador del calcio APPsα, porque las vías de escisión son mutuamente excluyentes. Los péptidos Aß pueden ensamblarse en estructuras fibrosas denominadas fibrillas y formar cúmulos moleculares.
Las consecuencias de la alteración de la permeabilidad al calcio
Esta deposición entre las neuronas conduce a una alteración de la permeabilidad al calcio de los canales de calcio dependientes de voltaje. Además, se alteran las moléculas sinápticas que sirven de sitios de acoplamiento para el neurotransmisor glutamato y que están asociadas a la capacidad de funciones cerebrales superiores como el aprendizaje y la memoria. Se trata de los receptores NMDA (asociados a los canales iónicos permeables al calcio en la membrana celular), que se eliminan de la membrana sináptica como resultado de la deposición de Aß. Esto pone en marcha otras cascadas de efectos negativos que interrumpen permanentemente la transmisión de señales entre las neuronas.
Punto de partida del estudio
Mientras que hasta la fecha numerosos estudios han examinado las consecuencias de las corrientes de calcio alteradas por el Aß, hay muy pocos estudios dedicados al papel fisiológicamente importante del APP, sus homólogos y sus dominios funcionales. Korte y compañía han abordado esta cuestión en su estudio actual, publicado en la revista de renombre internacional de la Academia Americana de Ciencias, PNAS. Los resultados sugieren que no sólo el aumento de la liberación de Aβ puede considerarse un riesgo para el desarrollo de la demencia de Alzheimer: Al inicio de la enfermedad, es más probable que la reducción de la producción de APPsα sea la causa del deterioro del equilibrio del calcio y de su dinámica.
La dinámica del calcio y la función de almacenamiento del calcio están restringidas
Además, el equipo de autores, entre los que se encuentra la renombrada investigadora del Alzheimer, la profesora Ulrike Müller, que imparte clases en la Universidad de Heidelberg, pudo demostrar que, junto con la proteína APP, la relacionada APLP2 controla la dinámica del calcio, así como el rellenado de los almacenes internos de calcio (denominados retículo endoplásmico, RE) dentro de las neuronas de una forma desconocida hasta ahora.
Alteración de las capacidades de adaptación de las células cerebrales
Además, todo esto conduce a una interrupción de la plasticidad sináptica, es decir, la capacidad de las sinapsis y las neuronas para optimizar sus propiedades circuitales durante los eventos de aprendizaje. Estos procesos celulares de cambio sináptico, tan importantes para los procesos de aprendizaje y memoria, se ven perturbados sobre todo por el hecho de que una molécula de transporte, que bombea calcio en grandes cantidades a los almacenes internos, deja de funcionar correctamente, y además se produce en cantidades alteradas (en jerga técnica: la función y la expresión están perturbadas). Esta bomba, denominada serca-ATPasa, se encarga de bombear el calcio liberado dentro de la célula de vuelta al almacén interno para poder liberar luego el calcio rápidamente y en grandes cantidades dentro de la neurona durante la transmisión de estímulos. Además, los neurocientíficos descubrieron que la expresión de dos proteínas asociadas a los canales de calcio (Stim1 y Stim2) está alterada en ausencia de APP y APLP2.
Intento de restablecer el equilibrio en la escisión de APP mediante la formación estimulada de APPsα
En este estudio, se utilizó la expresión a largo plazo de APPsα para intentar restaurar el equilibrio en la escisión de APP. Esto debería prevenir o aliviar los síntomas de la enfermedad - al menos en el modelo de ratón de la enfermedad de Alzheimer. Se observó que sólo una expresión compensatoria a largo plazo de APPsα fue capaz de restaurar el equilibrio de calcio fisiológicamente importante. Además, se pudo restaurar la plasticidad sináptica previamente deteriorada. APPsα normalizó y rescató la expresión normal de la ATPasa Serca y de las proteínas Stim1 y 2, lo que posteriormente también restauró la concentración de calcio dentro de los almacenes internos de calcio (ER) a un nivel saludable.
La eficacia del APPsα a través de la terapia génica ya se había demostrado en modelos animales de la enfermedad de Alzheimer (publicado en Fol et al. Acta Neuropathol 2016, de nuevo con la participación de investigadores de la UT). Aquí, el péptido se administró de forma aguda o crónica y fue capaz de eliminar las alteraciones típicas de la demencia en la plasticidad sináptica y en los procesos de memoria siguientes.
Conclusión
En resumen, este estudio demuestra un papel central e importante de la familia de proteínas APP, concretamente del fragmento APPsα de la proteína APP liberado extracelularmente, en la homeostasis del calcio. Estos hallazgos complementan la ya conocida función promotora del crecimiento y neuroprotectora de APPsα en las neuronas y añaden a este conocimiento los nuevos hallazgos de que APPsα también está implicada en la regulación de la dinámica del calcio. De este modo, se pone de manifiesto el potencial terapéutico de este dominio para la terapia de la enfermedad de Alzheimer.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.