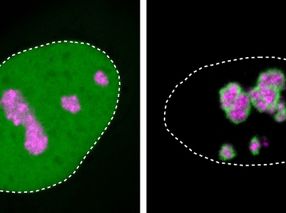
Un gen defectuoso ralentiza las células cerebrales
Cómo afecta al desarrollo del cerebro un gen de alto riesgo para desarrollar el trastorno del espectro autista
Aunque se cree que muchas formas de trastorno del espectro autista (TEA) tienen causas genéticas, las funciones celulares y moleculares de los genes identificados siguen sin estar claras. Científicos del Instituto de Ciencia y Tecnología (IST) de Austria estudiaron un gen de alto riesgo y descubrieron su importante función durante una fase crítica del desarrollo del cerebro.
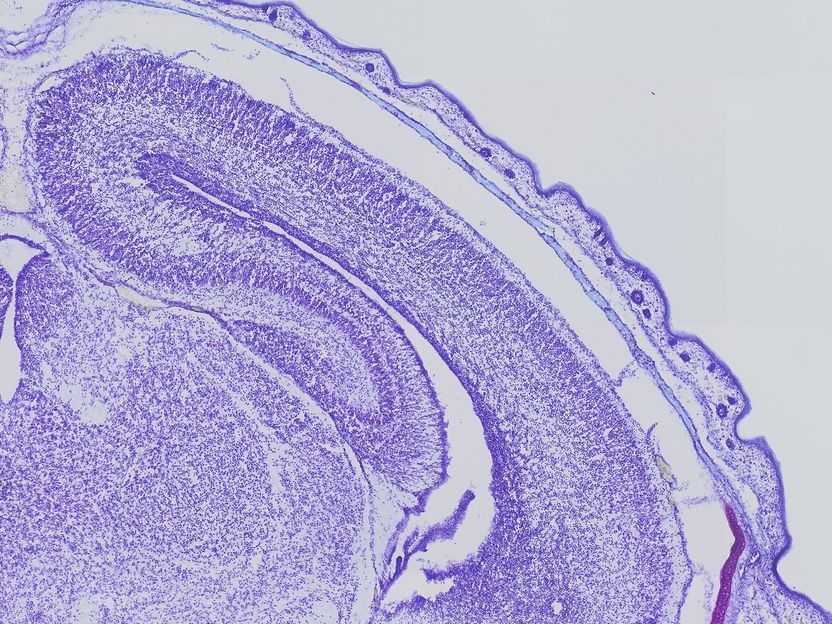
Malformaciones del córtex: Al analizar el cerebro de los ratones cuya Cullin 3-Gen ha sido parcialmente desactivada, los científicos encontraron malformaciones del córtex.
IST Austria
Sólo en la Unión Europea hay unos tres millones de personas afectadas por un trastorno del espectro autista (TEA). Algunas sólo están afectadas de forma leve y pueden llevar una vida independiente. Otras tienen discapacidades graves. Lo que tienen en común las distintas formas es la dificultad para la interacción social y la comunicación, así como los comportamientos repetitivos-estereotípicos. Las mutaciones en unos cientos de genes están asociadas al TEA. Uno de ellos se llama Cullin 3, y es un gen de alto riesgo: Una mutación de este gen conduce casi con toda seguridad a un trastorno. Pero, ¿cómo afecta exactamente este gen al cerebro? Para saber más, Jasmin Morandell y Lena Schwarz, estudiantes de doctorado del grupo de investigación de la profesora Gaia Novarino, recurrieron a ratones cuyo gen Cullin 3 ha sido parcialmente desactivado y los compararon con sus hermanos sanos. Sus resultados acaban de publicarse en la revista Nature Communications.
En una serie de pruebas conductuales y motoras, el equipo quería ver si los ratones modificados imitaban algunas de las características de los pacientes con esta forma de autismo y, por tanto, podían utilizarse como organismos modelo. En una de estas pruebas, la llamada prueba de sociabilidad de tres cámaras, un ratón podía explorar libremente tres cámaras adyacentes de una caja conectada por pequeñas puertas. Los científicos colocaron otros dos ratones en las cajas exteriores: Uno ya era familiar para el ratón estudiado, el otro ratón no lo conocía. "Los ratones sanos suelen preferir al nuevo sobre el ratón ya conocido", explica Jasmin Morandell, coprimera autora del estudio. El ratón con el gen Cullin 3 alterado, sin embargo, no mostró ningún signo de reconocimiento. Además, los ratones presentaban déficits de coordinación motora, así como otras deficiencias cognitivas relacionadas con el TEA. Con la ayuda de este modelo de ratón, el equipo pudo llegar al fondo de los mecanismos que provocan estos cambios.
Una peligrosa acumulación de proteínas
Al estudiar el cerebro del ratón, los investigadores observaron un cambio muy sutil pero constante en la posición de algunas células cerebrales. Estas llamadas neuronas o células nerviosas se originan en una región especial del cerebro. Desde allí, migran hacia las capas superiores hasta encontrar su lugar designado en el córtex. Se trata de un proceso muy sensible, en el que incluso pequeños cambios en la velocidad a la que viajan pueden cambiar la estructura de la corteza. Al marcar las neuronas que migran, los científicos pudieron rastrear sus movimientos. "Pudimos observar los déficits de migración: las neuronas se quedan varadas en las capas inferiores del córtex", describe Lena Schwarz, la otra coprimera autora del estudio. Pero, ¿por qué las células no se mueven como deberían?
La respuesta está en el importante papel que desempeña Cullin 3 al final de la vida de las proteínas. Cuando ha llegado su hora, el gen Cullin 3 las marca para su degradación, un proceso que tiene que estar estrechamente regulado para evitar que las proteínas se acumulen. Para averiguar qué proteínas están mal reguladas cuando la Cullina 3 es defectuosa, Morandell y Schwarz analizaron sistemáticamente la composición proteica del cerebro de los ratones. "Estuvimos buscando las proteínas que se acumulan en el cerebro mutante y encontramos una proteína llamada Plastina 3. Entonces Gaia se topó con un póster que describía el trabajo del grupo Schur del IST de Austria en el pasillo, y nos emocionamos mucho", dice Jasmin Morandell. "Ellos habían estado trabajando de forma independiente en la plastina 3 como regulador de la motilidad celular y tenían resultados complementarios a los nuestros. Fue entonces cuando empezamos a trabajar juntos", recuerda la profesora Gaia Novarino.
Resultó que la proteína Plastin 3, hasta entonces desconocida en el contexto de la migración de las células neuronales, desempeña en realidad un papel importante en este proceso. "Si el gen Cullin 3 se desactiva, la proteína Plastin 3 se acumula, lo que hace que las células migren más lentamente y en distancias más cortas. Esto es exactamente lo que vimos que ocurría en el córtex de los ratones mutantes de Cullin 3", dice la estudiante de doctorado Lena Schwarz.
¿Una vía arriesgada?
Todo esto ocurre en una fase muy temprana del desarrollo del cerebro, en torno a la mitad de la gestación, mucho antes de que nadie note ninguna diferencia en el feto. "Determinar estas ventanas críticas durante el desarrollo del cerebro podría ser extremadamente importante para afinar el tratamiento de los pacientes con formas específicas de TEA", explica Novarino, que se ha comprometido a mejorar el diagnóstico y las opciones de tratamiento para las personas con TEA. "El seguimiento de la investigación sobre la plastina 3 podría allanar el camino para algunas terapias. Inhibir la acumulación de esta proteína podría acabar aliviando algunos de los síntomas que presentan los pacientes", afirma Schwarz.
"Ahora sabemos que una Cullin 3 defectuosa provoca un aumento de los niveles de Plastin 3. Esta estrecha correlación demuestra que los niveles de la proteína Plastin 3 pueden ser un factor importante para el control de los movimientos intrínsecos de las células", dice Jasmin Morandell. Recientemente se ha graduado y podría utilizar su experiencia en el desarrollo del cerebro para estudiar la enfermedad de Huntington. Lena Schwarz se ocupará a continuación de otros genes de alto riesgo de TEA para ver cómo otras proteínas de la vía de degradación pueden estar relacionadas con el TEA. Para el presente estudio, el grupo de Novarino unió fuerzas con los grupos de Danzl y Schur y un colega de la Universidad de Roma. "Terminar este amplio estudio en unos dos años y medio a pesar de la pandemia sólo fue posible con el apoyo de nuestros vecinos del IST de Austria", alaba Novarino la multidisciplinariedad del Instituto.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.