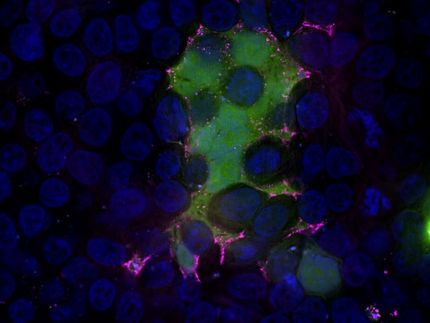
Organoides del mesencéfalo para la investigación automatizada de enfermedades y exámenes químicos.
Max Planck Innovation licencia el proceso de generación de agregados de tejidos similares a órganos a la empresa de biotecnología StemoniX
A veces es necesario probar cientos de miles de posibles terapias en experimentos a gran escala y totalmente automatizados para identificar una sola droga eficaz. La mayoría de los compuestos no funcionan como se desea, y algunos incluso son tóxicos. Desde el desarrollo de la tecnología de las células madre pluripotentes inducidas (iPS) en 2006, los investigadores han podido producir células madre a partir de biopsias de piel y muestras de sangre. Para abordar las condiciones fisiológicas en el laboratorio, muchos investigadores utilizan la tecnología celular iPS para producir agregados de tejidos tridimensionales similares a los órganos (organoides). Un equipo de científicos del Instituto Max Planck de Biomedicina Molecular de Münster ha logrado ahora utilizar células humanas para producir organoides del cerebro medio en un proceso totalmente automatizado. Tales organoides pueden ser producidos, cultivados y analizados en detalle dentro de un flujo de trabajo de alto rendimiento. La empresa de transferencia de tecnología Max Planck Innovation ha licenciado este proceso a la empresa biotecnológica americana StemoniX, Inc.

Con un robot de laboratorio como este, se pueden generar grandes cantidades de organoides de manera estandarizada. El robot permite a los científicos generar, cuidar y probar hasta 20.000 organoides cerebrales al día. A modo de comparación: no más de unos pocos cientos de organoides pueden ser cuidados a mano cada día. Estos también varían mucho y por lo tanto son inadecuados para el desarrollo de drogas.
Max Planck Institute for Molecular Biomedicine | Jan Bruder
La tecnología celular iPS es una solución ideal para la investigación terapéutica que requiere mucho tiempo y dinero. Las células madre pluripotentes inducidas se producen en el laboratorio a partir de células de la piel humana. Además, las células iPS pueden multiplicarse indefinidamente en cultivo y pueden convertirse en todos los tipos de células del cuerpo. De esta manera, es posible obtener líneas celulares iPS específicas para cada paciente que pueden servir como modelos de enfermedad. Esto es particularmente interesante para las enfermedades para las que no existen modelos animales adecuados, como la enfermedad de Parkinson.
Con el fin de imitar mejor las enfermedades en el laboratorio, los científicos han ido alejándose de los cultivos bidimensionales y desarrollando sistemas tridimensionales, ya que éstos reproducen más fielmente la diversidad celular, la estructura y las interacciones complejas del órgano. Los organoides son un ejemplo de tal sistema. "Los órganos crecen y maduran hasta convertirse en un agregado tisular a partir de células iPS o células precursoras específicas de tejido de forma autoorganizada, tal y como sucedería en el cuerpo humano", explica Jan Bruder, científico del Instituto Max Planck de Biomedicina Molecular y responsable del estudio. "Los órganos son más complejos, pueden imitar más plenamente las propiedades fisiológicas características del tejido y, por lo tanto, ofrecen varias ventajas funcionales respecto a los modelos tradicionales".
Los investigadores de Max Planck han realizado ahora importantes avances en la generación y el análisis de los organoides, lo que hace que sus descubrimientos sean adecuados para su aplicación en investigaciones a gran escala, como el descubrimiento de fármacos de alto rendimiento. En primer lugar, idearon una estrategia que creaba organoides de cerebro medio a partir de células precursoras neurales de moléculas pequeñas (smNPC), que tienen la capacidad de generar todas las células de cerebro medio pertinentes más rápidamente y con mayor reproducibilidad que los métodos actuales. De especial importancia es la generación de neuronas productoras de dopamina, que son precisamente las células nerviosas que mueren primero en el cerebro de los pacientes con Parkinson.
"En lugar de cultivar neuronas del mesencéfalo a partir de células iPS durante uno o dos meses, utilizamos smNPCs. Esto nos permitió obtener células nerviosas productoras de dopamina en dos semanas", dice Henrik Renner, autor principal del estudio y estudiante de doctorado en el Instituto Max Planck de Biomedicina Molecular.
El segundo avance fue demostrar que la producción de organoides podía lograrse con robots de pipeteo automatizados para producir grandes cantidades de organoides a partir de los smNPCs de manera reproducible.
Los resultados fueron a la vez agradables y prometedores: "Los organoides del mesencéfalo de las CNPML no sólo son muy homogéneos", dice Henrik Renner, "sino que también muestran características significativas del mesencéfalo humano y una actividad neural espontánea y sincronizada de gran amplitud, similar a la del tejido nervioso humano en desarrollo".
La tercera mejora fue la automatización del análisis. Aquí también, el equipo de investigación confió consistentemente en la robótica. "Desarrollamos un protocolo que nos permitió examinar los organoides en su totalidad de manera automatizada, apuntando a proteínas específicas en todo el organoide con anticuerpos y luego usando el microscopio de fluorescencia para capturar las imágenes", dice Henrik Renner.
La ventaja de este método es que los subtipos de células individuales pueden ser medidos en un sistema compatible de alto rendimiento en el organoide intacto. Así, por primera vez, los efectos de la droga pueden evaluarse a nivel de una sola célula dentro de un complejo entorno celular tridimensional en un flujo de trabajo de alto rendimiento totalmente automatizado. "La combinación de la producción y el análisis de los organoides en un mismo formato de cultivo, en el que todos los pasos están perfectamente entrelazados, es un importante paso adelante", subrayó Bruder. La investigación fue financiada por una subvención adelantada a Hans Schöler, como parte del programa ERC Horizonte 2020.
Procedimiento autorizado
Max Planck Innovation, la organización de transferencia de tecnología de la Sociedad Max Planck, ha concedido la licencia de este proceso a la empresa biotecnológica americana StemoniX, que tiene una capacidad demostrada de transferir e industrializar la innovación de las principales instituciones académicas como el Instituto Max Planck. StemoniX desarrolla construcciones de tejido microOrgan® en 3D basadas en células iPS, modelos de enfermedades y métodos analíticos avanzados para garantizar que sólo los compuestos más seguros y eficaces avancen a través de las líneas de descubrimiento de sus socios biofarmacéuticos.
Al combinar los procesos para la producción y el análisis automatizados de organoides extremadamente homogéneos del mesencéfalo humano con licencia del MPI, StemoniX está ampliando su plataforma microBrain® al mesencéfalo humano.
"Las nuevas tecnologías para la generación de organoides del mesencéfalo encajan perfectamente en nuestro enfoque de descubrimiento de medicamentos basado en el ser humano y en la capacidad de producir en masa modelos basados en células iPS altamente reproducibles y fisiológicamente relevantes", dice Ping Yeh, cofundador y director general de StemoniX. "Ya hemos demostrado la relevancia clínica de microBrain 3D en la detección temprana de la neurotoxicidad, así como su capacidad para descubrir y estratificar rápidamente nuevos objetivos y posibles terapias para enfermedades como el síndrome de Rett. La incorporación de la biología del cerebro medio y los modelos de enfermedades asociadas para afecciones como la enfermedad de Parkinson en nuestro microcerebro y la tecnología de AnalytiX™ fortalecerá los conductos biofarmacéuticos y acelerará el desarrollo terapéutico en múltiples enfermedades devastadoras".
Leonie Mönkemeyer, Gerente de Patentes y Licencias de Max Planck Innovation, concluye: "Estamos entusiasmados de ver que StemoniX avanza en nuestros descubrimientos científicos. Mediante la combinación de nuestras respectivas tecnologías, la búsqueda de terapias para múltiples trastornos neurológicos puede restringirse a un grupo más reducido de candidatos en una etapa temprana, determinando la eficacia y los efectos secundarios indeseables mucho antes de las fases clínicas. El uso de estos modelos en el desarrollo de medicamentos tiene el potencial de aumentar aún más el número de medicamentos recientemente aprobados y eficaces, así como de acortar significativamente los ciclos de desarrollo, lo que podría beneficiar a muchos pacientes cada año".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
Henrik Renner, Martha Grabos, Katharina J Becker, Theresa E Kagermeier, Jie Wu, Mandy Otto, Stefan Peischard, Dagmar Zeuschner, Yaroslav TsyTsyura, Paul Disse, Jürgen Klingauf, Sebastian A Leidel, Guiscard Seebohm, Hans R Schöler, Jan M Bruder; "A fully automated high-throughput workflow for 3D-based chemical screening in human midbrain organoids"; eLife; 2020;9:e52904.