En el lugar y el momento adecuados
Los científicos descifran la cadena de activación de la degradación de la proteína
Las proteínas son caballos de batalla moleculares en la célula que realizan tareas específicas, pero es esencial que el tiempo de las actividades de las proteínas esté exquisitamente controlado. Cuando las proteínas hayan cumplido sus tareas, la degradación de estas proteínas pondrá fin a procesos innecesarios o perjudiciales. Para controlar el tiempo, una etiqueta - llamada "ubiquitina" - se adhiere a las proteínas no deseadas, marcando la proteína para su degradación. Aunque se sabía que las complejas maquinarias moleculares fijaban la ubiquitina, se desconocía cómo estas máquinas llevan a cabo el proceso de etiquetado. Los investigadores del MPIB, en colaboración con la Universidad de Nevada de Las Vegas, han revelado estos mecanismos y publicado los resultados en la revista Nature.
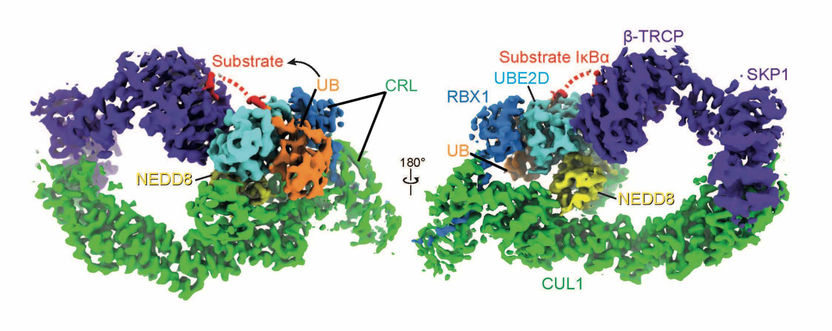
NEDD8 (amarillo) configura la forma de las ligas de anillos colinadores (verde y azul oscuro), UBE2D (azul claro) y ubiquitina (amarillo) de manera que la ubiquitina pueda unirse al sustrato objetivo (rojo: IκBα).
Kheewoong Baek © MPI für Biochemie
Numerosos procesos celulares como las respuestas inmunológicas o la multiplicación celular dependen de muchas proteínas diferentes que trabajan en secuencia. Para que la célula funcione correctamente, las proteínas deben ser degradadas después de su trabajo. Cuando las mutaciones que causan enfermedades bloquean la degradación oportuna de las proteínas, éstas podrían funcionar en el momento equivocado, lo que puede conducir a enfermedades, incluyendo cánceres, enfermedades cardíacas y trastornos del desarrollo.
Controlar la degradación de la proteína
Las células "saben" cómo descomponer las proteínas marcando las proteínas no deseadas para su degradación con otra proteína llamada "ubiquitina". El proceso de etiquetado, conocido como ubicuidad, se lleva a cabo mediante máquinas moleculares, llamadas ligasas E3. Es importante que las propias ligas E3 se enciendan y apaguen en las células en el lugar y el momento adecuados. El "encendido" de aproximadamente un tercio de todas las ligasas E3 es una pequeña proteína que se parece a la ubiquitina pero que se llama NEDD8.
NEDD8 en el control de apagar otras proteínas
Aunque se conocían los componentes individuales de estas maquinarias de degradación de proteínas, no estaba claro cómo NEDD8 conecta las ligasas E3 y permite marcar la proteína objetivo con ubiquitina. "Esto es especialmente importante porque hay fármacos en los ensayos clínicos anticáncer que bloquean la NEDD8, y algunas bacterias infecciosas manipulan la NEDD8 para perturbar los procesos celulares", dijo Brenda Schulman, jefe del departamento de "Máquinas Moleculares y Señalización" del MPIB. Schulman y su equipo han descifrado los mecanismos moleculares de esta ubicuidad. "Investigamos el modo de acción de un E3 encendido por NEDD8. Descubrimos cómo NEDD8 induce una máquina molecular E3 para llevar la etiqueta de ubiquitina a sus objetivos. Esta es la clave para apagar las proteínas en el momento adecuado, cuando ya no se necesitan en una célula", dijo Schulman.
Utilizando la química y la microscopía crioelectrónica, los científicos han logrado visualizar una importante ligasa E3, activada por NEDD8 y en el proceso de marcar un objetivo con ubiquitina. "Para ello, observamos de cerca cada paso del proceso de etiquetado. El proceso natural ocurre en una fracción de segundo, después de lo cual la máquina de marcado molecular se desmorona. El proceso de captación de este estado normalmente de corta duración fue particularmente difícil" explica Kheewoong Baek, autor principal del estudio. Las máquinas moleculares de ligasa E3 controlan muchos procesos celulares.
"El mecanismo descifrado no sólo explica el proceso normal y lo que va mal en algunos cánceres en los que las mutaciones impiden que la máquina E3 funcione, sino que también puede servir de guía para desarrollar terapias para etiquetar las proteínas no deseadas con ubiquitina. Esperamos que a largo plazo esto pueda ayudar a degradar las proteínas que causan el cáncer", resume Schulman.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.







































