Biología estructural: Entrega especial
Las proteínas globulares voluminosas requieren sistemas de transporte especializados para su inserción en las membranas. Ludwig-Maximilians-Universitaet (LMU) en Munich Los investigadores han determinado la estructura de tal sistema por primera vez, y proponen que explote el principio de la esclusa.
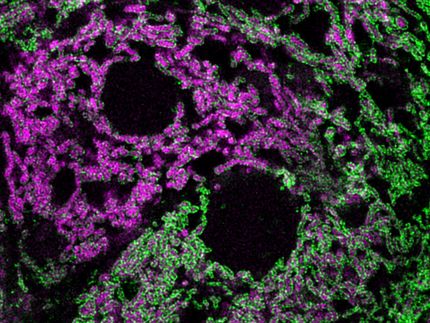
Muchas proteínas que son esenciales para la viabilidad celular deben ser transportadas a través de las membranas de los orgánulos intracelulares - como las mitocondrias - para llegar a sus sitios de acción. Por regla general, el transporte transmembrana tiene lugar antes de que la proteína recién sintetizada se haya plegado en su forma funcional final, ya que la forma desplegada puede ser extruida a través de un poro relativamente estrecho. El paso de las proteínas plegadas es una operación más difícil. Ocupan más espacio, por lo que el poro debe ser correspondientemente más grande. Las bacterias y los cloroplastos utilizan túneles dedicados a este fin. Aunque están relacionadas evolutivamente con las bacterias, las mitocondrias carecen de este tipo de apertura. Sin embargo, se las arreglan para transferir una importante proteína en su estado de plegado a través de su membrana interior. Ahora, los investigadores dirigidos por el Profesor Roland Beckmann en el Centro Genético LMU han reportado evidencia que sugiere que las mitocondrias logran esta desafiante hazaña haciendo uso del principio de la esclusa de aire. Beckmann y sus colegas describen sus hallazgos en un artículo que aparece en la revista Nature Structural and Molecular Biology.
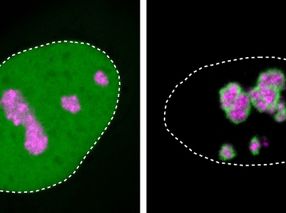
La proteína Rieske (llamada Rip1 en la levadura de panadería) pertenece a la clase 'hierro-azufre', y es un componente vital del proceso que permite a las mitocondrias generar ATP, que sirve como donante de energía universal para las reacciones bioquímicas en las células. Rip1 se sintetiza en forma precursora por medio de ribosomas citoplasmáticos, y se transporta en su estado desplegado a través de las membranas externas e internas del organelo hacia el compartimiento conocido como la matriz. Aquí, se procesa para producir la proteína Rip1. La incorporación de un "centro de hierro y azufre" le permite entonces adoptar su conformación funcional. Ahora, sin embargo, esta proteína globular debe ser insertada de nuevo en la membrana interior.
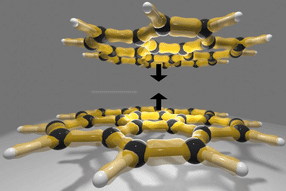
"El trabajo anterior de nuestros socios Walter Neupert y Nikola Wagener había demostrado que, en la levadura, una enzima llamada Bcs1 está involucrada en este paso final", dice Lukas Kater, autor principal del artículo. "Hemos determinado la estructura tridimensional de esta enzima con la ayuda de la microscopía crioelectrónica. - De hecho, esta es la primera estructura de alta resolución de un translocador eucariota para proteínas plegadas que se ha publicado." Con un mapa detallado de la configuración de la enzima a mano, el equipo se propuso descifrar cómo Bcs1 logra mediar selectivamente el paso de la forma plegada de Rip1 a través de la membrana interior sin permitir que otras moléculas o iones se deslicen por el poro.
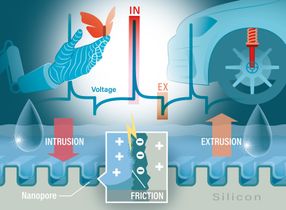
La Bcs1 pertenece a una clase de enzimas llamadas AAA-ATPases. Estas típicamente consisten en seis subunidades idénticas, que juntas forman un poro en forma de anillo. Sin embargo, los datos estructurales de la Bcs1 revelaron que está compuesta por siete subunidades, y por lo tanto forma un poro más grande. Pero eso no es todo. - El poro está dividido en dos cámaras claramente definidas. Una de ellas es directamente accesible desde la matriz de la mitocondria, mientras que la otra se encuentra dentro de la membrana interior. Crucialmente, están unidos por un dominio central que forma un sello entre ellos - que sin embargo puede ser abierto transitoriamente, como el equipo continuó mostrando.
"Por lo tanto, proponemos que el transporte a través de Bcs1 explote el principio de la esclusa", dice Beckmann. La proteína de Rieske pasa primero a través del gran poro y a la cámara de la matriz. Esto induce un cambio conformacional en el Bcs1, que hace que el sello entre las dos cámaras se abra, permitiendo que Rip1 entre en la esclusa de aire, la cámara dentro de la membrana interior. En el siguiente paso, el sello que separa las dos cámaras se forma de nuevo. "Asumimos que la esclusa se abre entonces para proporcionar acceso a una salida que permite que el dominio que contiene el centro de hierro y azufre emerja al espacio intermembranoso", añade Kater.
Los resultados del estudio no sólo proporcionan información sobre la función y el modo de acción de la Bcs1, sino que también deberían arrojar luz sobre una serie de enfermedades mitocondriales que se han vinculado a ella, como el síndrome de Gracile, que puede conducir a una muerte postnatal temprana, y el síndrome de Björnstad, que se asocia con la pérdida de audición. La disponibilidad de una estructura de alta resolución para la proteína debería permitir entender por qué las mutaciones asociadas a estas enfermedades tienen consecuencias tan devastadoras.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
Lukas Kater, Nikola Wagener, Otto Berninghausen, Thomas Becker, Walter Neupert, Roland Beckmann; "Structure of the Bcs1 AAA-ATPase suggests an airlock-like translocation 3 mechanism for folded proteins"; Nature Structural and Molecular Biology 2020