RedShift BioAnalytics
Messung der Sekundärstruktur von Proteinen in komplexen Formulierungen

Hochempfindliche Messungen, die die Grenzen herkömmlicher spektroskopischer Methoden überwinden
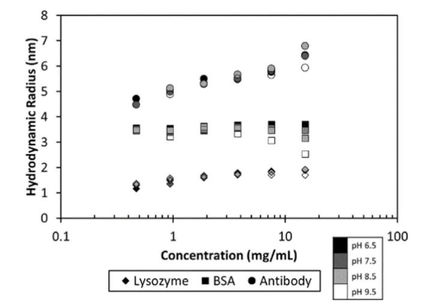
In dieser Studie wurde die MMS zur Charakterisierung der pufferbedingten Strukturunterschiede von Lysozym, einem gut charakterisierten alpha-Helix-reichen Protein, in Wasser und drei gängigen Formulierungspuffern eingesetzt: Phosphatpuffer (PB), phosphatgepufferte Kochsalzlösung (PBS) und Tris-Puffer. Absorptionsspektren in der Amid-I-Region wurden automatisch erfasst und verarbeitet, um die prozentualen Anteile der Strukturen höherer Ordnung (HOS) und die allgemeinen strukturellen Ähnlichkeiten zwischen den Proben unter allen vorbereiteten Bedingungen zu berechnen. Die Ergebnisse zeigten, dass das Enzym in den verschiedenen Puffern unterschiedliche strukturelle Veränderungen aufwies und dass diese Veränderungen quantifiziert werden konnten, um Entscheidungen über die Auswahl der Puffer zur Unterstützung der idealen Aktivität zu treffen.
Anzeigen