Ein "Tumor-Gen" enthüllt sein wahres Gesicht
Was in gesunden Zellen als „Notfall-Programm“ angelegt ist, nutzen Nierentumorzellen als permanenten Mechanismus um ihr rasantes Wachstum zu ermöglichen. Die Arbeitsgruppe von Christina Warnecke am Uniklinikum Erlangen hat ein in diesem Prozess vermutlich zentrales Gen unter die Lupe genommen. Das Hypoxie-induzierbare Gen 2 (HIG2) ist Bestandteil eines komplexen Programms, mit dem sich gesunde Zellen normalerweise vor Schäden durch Sauerstoffmangel (Hypoxie) schützen. Die Mediziner fanden heraus, dass HIG2 die vermehrte Speicherung von Fetttröpfchen in der Zelle anregt. Die Wissenschaftler wollen nun im Detail klären, welche Bedeutung HIG2 und die Fettdepots für das Tumorwachstum haben.
Mit der ständigen Aktivierung des Notfall-Programms schaffen die Nierentumorzellen erst die Voraussetzungen für ihr übermäßiges Wachstum: Sie regen die sauerstoffunabhängige Energieproduktion in den Zellen an und stimulieren die Bildung von Blutkapillaren und damit die Versorgung des Tumors mit Sauerstoff. Um Tumore künftig wirksamer behandeln zu können, müssen Mediziner und Wissenschaftler alle Facetten des genetischen Programms, das durch Sauerstoffmangel angeschaltet wird, möglichst genau verstehen. Da HIG2 die Speicherung von Neutralfetten in Zellen fördert, könnten die Erkenntnisse auch helfen, die Mechanismen bei Arterienverkalkung (Atherosklerose) und bestimmten Formen der Leberverfettung besser zu verstehen.
Die Gruppe um Christina Warnecke hat wesentlich dazu beigetragen, die Funktion von HIG2 zu enthüllen und mit althergebrachten Vermutungen aufzuräumen. Christina Warnecke: „Unser Verständnis der Funktion von HIG2 hat sich infolge unserer Forschungsergebnisse grundlegend gewandelt. HIG2 fördert nicht die Transformation von Zellen zu Tumorzellen und hat auch keinen direkten Einfluss auf die Zellteilung.“
Die Wissenschaftler konnten zum Beispiel die Ergebnisse einer japanischen Studie korrigieren, die postulierte, dass HIG2 ein von den Nierenkarzinomzellen gebildeter und ausgeschleuster Botenstoff sein könnte, der bei anderen Zellen die Zellteilung anregt und damit das Tumorwachstum fördert. Die Erlanger Mediziner wiesen nach, dass HIG2 nicht spezifisch für Nierenkarzinomzellen ist, obwohl es von diesen Zellen aufgrund ihres Gen-Defekts tatsächlich in großen Mengen produziert wird. HIG2 ist überdies in allen Zellen des Körpers nachweisbar, wird aber bei Sauerstoffmangel vermehrt gebildet.
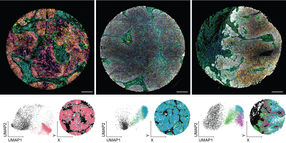
Mit Hilfe eines spezifischen Antikörpers gelang es der Gruppe um Warnecke, das HIG2 Protein in Zellkulturen und in Nierenzelltumoren von Patienten anzufärben. HIG2 ist in Zellen an bläschenförmigen Strukturen nachweisbar, die anfangs fälschlicherweise für Zellorganellen gehalten wurden. Es stellte sich jedoch heraus, dass die bläschenförmigen Strukturen Fetttropfen (engl. lipid droplets) sind. Die Fetttröpfchen werden von einer einschichtigen Membran umgeben, in der das HIG2 Protein verankert ist. Intrazelluläre Fetttropfen wurden lange Zeit von der Wissenschaft ungenügend beachtet, weil sie als einfache, passive Speicherpartikel angesehen wurden. Die Identifizierung von mittlerweile fast zweihundert verschiedenen Proteinen in und auf Fetttropfen zeigte jedoch, dass intrazelluläre Fetttropfen den Zellorganellen ähnlich sind, weil sie vielfältige Funktionen in der Zelle ausüben können und in einem aktiven und sehr dynamischen Wechselspiel mit anderen Zellorganellen stehen. Da Tumorzellen einen höheren Energiebedarf haben als normale Zellen, könnte der durch HIG2 unterstützte Aufbau von Fettspeichern die Tumorzellen vor Energiedefiziten in Phasen eines niedrigen Blutzuckerspiegels schützen.
Die Wissenschaftler konnten HIG2 nicht nur in Nierentumoren nachweisen, sondern auch in den Wänden von atherosklerotischen Herzkranzgefäßen und in bestimmten Fällen von Leberverfettung. Dies legt nahe, dass neben einer ernährungsbedingten Verfettung auch Sauerstoffmangel bei der Entstehung dieser Erkrankungen eine wichtige Rolle spielt. Die ernährungsbedingte Verfettung ist die häufigste Form der Fettspeicherung beim Menschen und betrifft zunächst überwiegend das Fettgewebe, aber auch die Leber und die Skelettmuskulatur. Sauerstoffmangel führt über einen ganz anderen Mechanismus zu einer zunächst zeitweisen Fettablagerung in Zellen - nämlich indem der Fettabbau unterbrochen wird. Die dabei in den Zellen angehäuften freien Fettsäuren können entzündungsauslösende und sogar zelltoxische Wirkungen haben und müssen daher unschädlich gemacht werden. Dies geschieht durch die Umwandlung in Neutralfette und Speicherung in Fetttropfen. Beide Mechanismen der intrazellulären Fettablagerung, die ernährungsbedingte und die hypoxische, können zusammenwirken und dazu führen, dass aus einer zunächst harmlos erscheinenden Fettansammlung ein entzündungsähnlicher Zustand resultiert, bei der von den Zellen Botenstoffe abgegeben werden, die auch andere Organe und die Blutgefässe schädigen.
Für die umfangreichen Untersuchungen haben Christina Warnecke und Tina Gimm ein spezielles Zellkultursystem entwickelt, in dem sie HIG2 künstlich in Zellen in einem Ausmaß produzieren, wie es unter Sauerstoffmangel oder in Nierenzellkarzinomen beobachtet wird. Dabei stellten sie fest, dass die Überproduktion von HIG2 allein ausreicht, um auch bei genügend Sauerstoffzufuhr in den Zellen eine verstärkte Ablagerung von Fetten auszulösen. „Da Tumorzellen einen höheren Energiebedarf haben als normale Zellen, könnte der durch HIG2 unterstützte Aufbau von Fettspeichern die Tumorzellen vor Energiedefiziten in Phasen eines niedrigeren Blutzuckerspiegels schützen“, erläutert Warnecke. In den HIG2-produzierenden Zellen stieg außerdem die Produktion von Botenstoffen, die Entzündungsprozesse fördern. Einer dieser Botenstoffe regt auch die Bildung von neuen Blutgefäßen an. Dies könnte einer der Mechanismen sein, wie HIG2 in Nierenzellkarzinomen das Tumorwachstum indirekt unterstützt. Eine direkte Stimulation der Zellteilung durch HIG2 konnten Warnecke und Gimm nicht nachweisen. Auch in subkutanen Tumoren in Mäusen hatte die Menge von HIG2 in den Tumorzellen nur einen sehr geringen und vorübergehenden Einfluss auf das Tumorwachstum.
„Die Erkenntnis, dass HIG2 ein Fetttropfenprotein ist, bestätigt, dass der molekulare Schalter, der bei Sauerstoffmangel das genetische Notfall-Programm aktiviert, in erster Linie eine Schutzfunktion für Zellen hat und nicht direkt das Tumorwachstum fördert“, resümiert die Medizinerin. Mit welchen Mechanismen HIG2 das Tumorwachstum aber indirekt unterstützt, wollen Warnecke und ihr Team im nächsten Schritt klären.
Die Wilhelm Sander-Stiftung fördert die Fortsetzung dieses Forschungsprojekt mit weiteren Mitteln von über 20.000 €, nachdem bislang über 80.000 € Fördermittel geflossen sind.