Avanço na investigação do metano: descodificado o mecanismo de ativação da enzima produtora de metano
a publicação "Nature" revela a ligação evolutiva entre dois processos biológicos fundamentais
Anúncios
Os investigadores do Centro de Microbiologia Sintética (SYNMIKRO) da Philipps-Universität Marburg e da TU Berlin fizeram um grande avanço na compreensão da ativação da metil-coenzima M redutase (MCR) - a enzima responsável por quase toda a produção biológica de metano e uma das enzimas mais abundantes na Terra. Os seus resultados foram agora publicados na "Nature" e não só lançam nova luz sobre um dos mais antigos processos de produção de energia na natureza, como também revelam uma inesperada ligação evolutiva à chamada fixação do azoto.
Nesta primeira etapa do ciclo global do azoto, os microrganismos absorvem o azoto do ar e convertem-no para que os organismos vivos o possam utilizar. "A investigação fundamental no domínio da energia biológica e da conversão de materiais tem um potencial considerável para enfrentar os desafios actuais, tais como o aumento constante das necessidades energéticas da humanidade e o avanço das alterações climáticas", explica o Dr. Christian Lorent, coautor da publicação "Nature" e investigador associado do Cluster of Excellence Unifying Systems in Catalysis (UniSysCat), sediado na TU Berlin.
Os dois lados do gás com efeito de estufa
As archaea metanogénicas são microrganismos que existem há milhares de milhões de anos e produzem até mil milhões de toneladas de metano por ano, por exemplo, no estômago dos ruminantes ou em zonas húmidas. Embora o metano seja um potente gás com efeito de estufa que contribui para o aquecimento global, a produção biológica de metano tem também um grande potencial como fonte de energia renovável através da produção de biogás na agricultura. Uma compreensão mais profunda dos mecanismos básicos da formação de metano pode conduzir a avanços nas tecnologias energéticas sustentáveis e na proteção do clima.
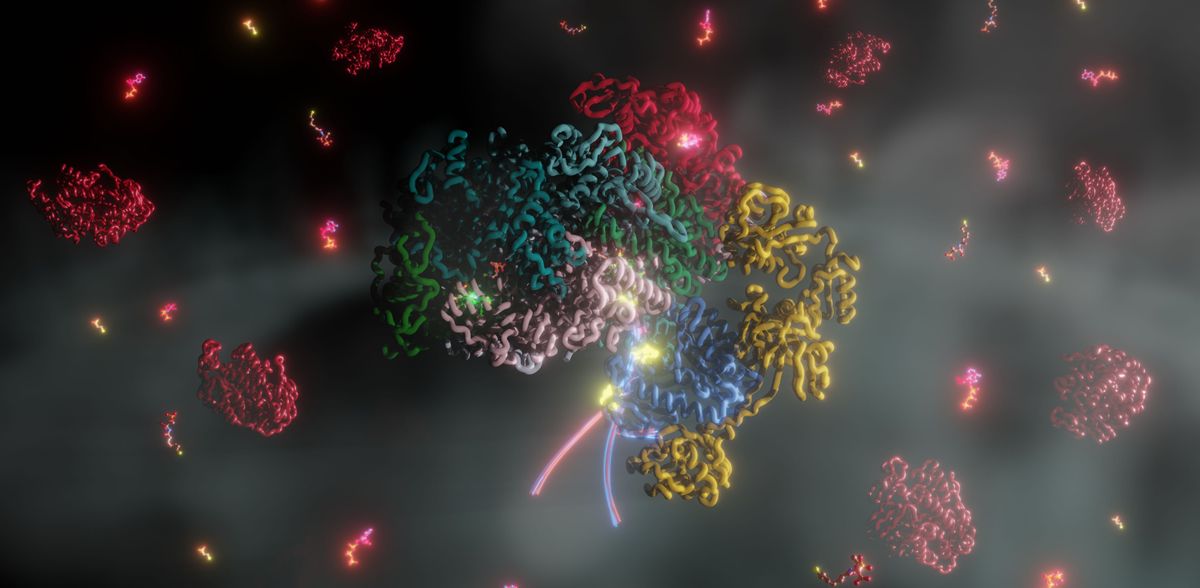
Uma das reacções redox mais difíceis
No centro da produção biológica de metano está a MCR, uma enzima altamente especializada cujo centro ativo contém a coenzima única F430. A função deste cofator depende crucialmente de um ião de níquel central, que deve estar no estado de oxidação Ni(1+) para catalisar a produção de metano. No entanto, a ativação do níquel para este estado exige a superação de um obstáculo energético considerável - uma das reacções redox mais difíceis na natureza. Há muito que não se sabe como é que as formas de vida primitivas conseguiram esta ativação.
No seu estudo, a equipa de investigação conseguiu isolar e caraterizar o complexo de ativação MCR do organismo modelo Methanococcus maripaludis. "Descobrimos que uma pequena proteína chamada McrC, juntamente com outras proteínas marcadoras metanogénicas, ativa a MCR num processo dependente de ATP, fornecendo assim a energia necessária para a produção de metano", explica Fidel Ramírez-Amador, da Universidade Philipps de Marburgo, um dos principais autores do estudo.
As análises espectroscópicas forneceram a prova que faltava
De forma notável, os investigadores conseguiram demonstrar que o mecanismo de ativação requer três complexos metálicos estruturados de forma única e altamente especializados, que até agora só eram conhecidos na nitrogenase, a única enzima capaz de converter o azoto atmosférico em formas biologicamente disponíveis. "As investigações espectroscópicas forneceram a prova que faltava de que estes cofactores consistem em ferro e enxofre e são provavelmente cruciais para a transferência de electrões", explica o Dr. Christian Lorent. O Dr. Jan Schuller da Universidade Philipps de Marburg, autor sénior do estudo, acrescenta: "Esta semelhança impressionante sugere que estes sistemas têm uma origem evolutiva comum, apesar de terem funções completamente diferentes. O nosso estudo estabelece uma ligação evolutiva sem precedentes entre dois processos biológicos fundamentais: a metanogénese e a fixação de azoto".
"As soluções mais elegantes para a produção de energia e os catalisadores mais eficientes foram evolutivamente optimizados na natureza ao longo de milhões de anos. Cabe-nos a nós, cientistas, encontrá-las, compreendê-las e aplicá-las", resume o Dr. Christian Lorent. No Cluster de Excelência UniSysCat, ele investiga os mecanismos de reação e o acoplamento de várias metaloenzimas, que também podem produzir hidrogénio ou ligar o gás de estufa dióxido de carbono, por exemplo.
Observação: Este artigo foi traduzido usando um sistema de computador sem intervenção humana. A LUMITOS oferece essas traduções automáticas para apresentar uma gama mais ampla de notícias atuais. Como este artigo foi traduzido com tradução automática, é possível que contenha erros de vocabulário, sintaxe ou gramática. O artigo original em Alemão pode ser encontrado aqui.
Publicação original
Fidel Ramírez-Amador, Sophia Paul, Anuj Kumar, Christian Lorent, Sebastian Keller, Stefan Bohn, Thinh Nguyen, Stefano Lometto, Dennis Vlegels, Jörg Kahnt, Darja Deobald, Frank Abendroth, Olalla Vázquez, Georg Hochberg, Silvan Scheller, Sven T. Stripp, Jan Michael Schuller; "Structure of the ATP-driven methyl-coenzyme M reductase activation complex"; Nature, 2025-4-16