Une nouvelle méthode pour identifier les agents pathogènes encore inconnus
Compromis évolutifs : Équilibrer les risques de maladies génétiques et la protection contre les agents pathogènes
Certains gènes peuvent exister sous différentes variantes, fonctionnellement divergentes, chez les individus d'une espèce. S'ils entraînent des différences nettes, par exemple dans un phénotype ou une susceptibilité à une maladie, on parle en biologie de polymorphisme. Des exemples typiques sont un certain nombre de gènes dont les variantes sont responsables de l'expression de différents groupes sanguins. Il est intéressant de noter que ces gènes polymorphes peuvent concerner à la fois les groupes sanguins et les maladies. Une équipe de chercheurs de l'université de Kiel et de l'Institut Max Planck de biologie évolutive (MPI-EB), dirigée par le professeur John Baines, a utilisé des souris comme exemple pour étudier un de ces gènes polymorphes, appelé B4galnt2, qui, chez l'animal, peut affecter les vaisseaux sanguins et/ou les cellules intestinales.
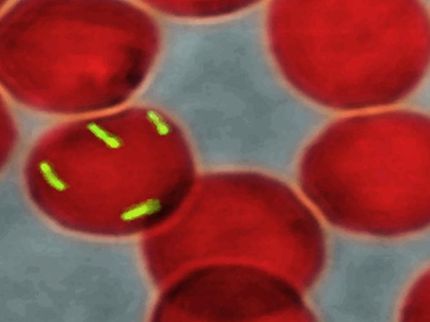
Dans cette nouvelle étude, les chercheurs de la section de médecine évolutive de l'université de Kiel et du MPI-EB ont pu montrer que, selon la variante, le gène peut provoquer non seulement un trouble de la coagulation sanguine, mais aussi une meilleure immunité aux infections bactériennes. Les chercheurs, qui sont actifs au sein du centre de recherche collaborative (CRC) 1182 "Origine et fonction des méta-organismes" et du pôle d'excellence "Médecine de précision dans l'inflammation chronique" (PMI), ont réussi à démontrer l'implication d'une variante individuelle de B4galnt2 dans la défense contre les agents pathogènes en identifiant une bactérie inconnue du genre Morganella. Ce groupe de micro-organismes peut provoquer des infections problématiques chez l'homme, notamment dans les hôpitaux et les établissements de soins. Dans une analyse dite pathométagénomique, les chercheurs ont montré que la prévalence de cette bactérie liée à l'inflammation est fortement limitée chez les souris présentant le génotype B4galnt2 affectant les vaisseaux sanguins. Ils ont ainsi réussi à élucider un compromis évolutif exemplaire entre le risque de maladie génétique et l'avantage évolutif de résistance aux agents pathogènes que les souris obtiennent en conservant le polymorphisme de ce gène. Les chercheurs ont récemment publié leurs résultats dans la revue scientifique Gut Microbes.
Image symbolique
Computer-generated image
Équilibrer les compromis évolutifs
Au cours de l'évolution, certaines variantes génétiques importantes pour la défense immunitaire sont favorisées par la pression sélective des maladies infectieuses, et les variantes correspondantes sont donc maintenues. Le maintien de ces gènes est toutefois souvent lié à ce que l'on appelle des compromis évolutifs : On sait par exemple que les souris ont conservé des formes alternatives (c'est-à-dire des allèles) du gène B4galnt2, lié au groupe sanguin, pendant près de trois millions d'années, bien que ce gène soit à l'origine d'un phénotype de temps de saignement similaire à celui de la maladie de von Willebrand chez l'homme, qui provoque des saignements prolongés après une blessure. "Le maintien d'une telle variante génétique doit être associé à un fort avantage sélectif dans d'autres contextes, qui étaient jusqu'à présent inconnus", explique le biologiste évolutionniste Baines. "Les récentes avancées dans la compréhension scientifique du système de coagulation du sang suggèrent maintenant que la variation génétique peut également être impliquée dans l'immunité innée et la défense contre les pathogènes, nous avons donc cherché un avantage possible du gène B4galnt2 dans ce domaine", poursuit Baines.
L'analyse pathométagénomique montre des liens entre la variation génétique et la protection contre les pathogènes
Afin d'étudier le rôle de la variation du gène B4galnt2 dans une éventuelle immunité aux agents pathogènes, l'équipe de recherche de Kiel a choisi une nouvelle approche, dite pathométagénomique : Les chercheurs ont d'abord examiné les tissus intestinaux des animaux à la recherche de signes d'inflammation. Dans un deuxième temps, ils ont identifié les micro-organismes présents dans l'intestin des animaux par séquençage du génome afin de détecter des corrélations entre la composition du microbiome et les signes d'inflammation. "La composition globale du microbiote ne semble pas jouer un rôle significatif au départ. Cependant, on a constaté que des espèces bactériennes individuelles étaient disproportionnellement actives en présence d'une inflammation et de génotypes particuliers de B4galnt2", résume Baines.
Les chercheurs ont pu limiter cette observation à une sous-espèce bactérienne du genre Morganella, jusqu'alors inconnue : Les animaux présentant l'allèle pertinent pour les vaisseaux sanguins et le risque associé de coagulation du sang présentaient moins de signes d'inflammation, la bactérie étant quasiment absente. Chez les souris exprimant B4galnt2 dans le tractus gastro-intestinal, en revanche, elle est clairement détectable ; la présence d'une inflammation indique ici son caractère pathogène. "Bien que ces animaux ne présentent pas le risque du phénotype hémorragique, l'expression de B4galnt2 dans la muqueuse intestinale peut être favorisée par des agents pathogènes. Dans le cas de notre analyse, c'est Morganella qui conduit alors à l'inflammation", précise M. Baines.
Une nouvelle façon d'identifier des agents pathogènes encore inconnus
Afin de valider leurs résultats sur des souris sauvages, les chercheurs de Kiel ont collaboré avec le groupe du professeur Guntram Grassl, microbiologiste médical à la faculté de médecine de Hanovre. Les chercheurs ont ensuite validé ces résultats issus d'animaux sauvages par des expériences d'infection réalisées en laboratoire sur des souris qui ne différaient que par les allèles présents au niveau du gène B4galnt2. Lorsque ces animaux ont été inoculés avec la bactérie, ils ont présenté les mêmes signes de maladie que les animaux sauvages. "Nous disposons ainsi de la preuve expérimentale que le gène B4galnt2 joue un rôle important dans la sensibilité aux infections bactériennes dans la nature. Cela nous a permis de valider que notre nouvelle approche pathométagénomique est en principe adaptée à l'identification d'agents pathogènes encore inconnus chez les animaux sauvages, et donc à la surveillance des risques éventuels de ces agents pathogènes zoonotiques pour l'homme", explique M. Grassl.
Avec les travaux présentés aujourd'hui, l'équipe de recherche de Kiel a également pu apporter des preuves supplémentaires à l'hypothèse de longue date sur les origines évolutives des systèmes de groupes sanguins en général : "Un important pionnier de la biologie de l'évolution, le généticien britannique J. B. S. Haldane, avait prévu dès le milieu du XXe siècle que les groupes sanguins et la résistance aux agents pathogènes pouvaient être liés les uns aux autres. Grâce à la recherche sur les gènes liés aux groupes sanguins, qui sont une cible particulièrement courante de la sélection naturelle, de nombreux exemples de ce phénomène ont été décrits plus récemment", explique M. Baines. "Cependant, la nature et l'étendue des compromis évolutifs impliqués sont rarement explorés en détail. Grâce à notre analyse pathométagénomique, nous avons réussi à établir un lien entre la résistance aux agents pathogènes et un gène lié au groupe sanguin, soutenant ainsi expérimentalement l'hypothèse de Haldane", poursuit Baines.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.
Publication originale
Marie Vallier, Abdulhadi Suwandi, Katrin Ehrhardt, Meriem Belheouane, David Berry, Aleksa Čepić, Alibek Galeev, Jill M. Johnsen, Guntram A. Grassl and John F. Baines (2023): Pathometagenomics reveals susceptibility to intestinal infection by Morganella to be mediated by the blood group-related B4galnt2 gene in wild mice. Gut Microbes; First published: 22. January 2023