Verrouillage pour les cellules tumorales
Un nouvel inhibiteur immobilise les cellules tumorales
Les protéines phosphatases sont les contreparties des protéines kinases et, ensemble, ces deux groupes d'enzymes contrôlent pratiquement tous les aspects du comportement cellulaire. Par conséquent, la possibilité de moduler l'activité de kinases ou de phosphatases spécifiques est à la base d'une liste croissante de traitements médicaux, allant de l'atténuation de l'inflammation lors d'une transplantation d'organe à l'arrêt de la prolifération des cellules leucémiques. Un nouvel inhibiteur, découvert à l'université de Constance, bloque une enzyme critique à l'intérieur des cellules tumorales, verrouillant ainsi les cellules en place. Ce verrouillage cellulaire empêche les cellules tumorales d'envahir les tissus sains voisins, ouvrant ainsi la voie à la suppression des métastases tumorales. Ces résultats ont été publiés dans l'édition en ligne de "Cell Chemical Biology" le 19 avril 2022.
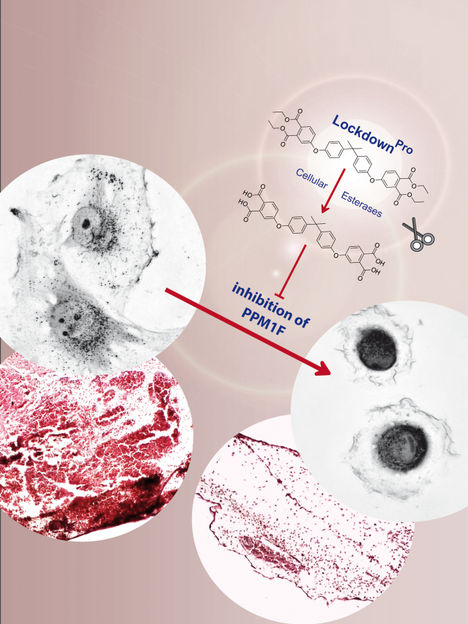
En inhibant sélectivement la protéine phosphatase PPM1F, LockdownPro bloque l'invasion des cellules tumorales.
Tanja Grimm und Marleen Herbinger, Universität Konstanz
Tous les processus cellulaires de notre organisme, y compris la croissance, la prolifération, la différenciation et la migration, dépendent de l'interaction entre les protéines kinases et les protéines phosphatases, des enzymes qui régulent l'état de phosphorylation et, par conséquent, la fonction des protéines. Lorsque la phosphorylation de protéines clés échappe à tout contrôle, les cellules subissent de graves conséquences. Il n'est pas surprenant que la phosphorylation déréglée des protéines soit l'une des caractéristiques des cellules cancéreuses.
C'est pourquoi les inhibiteurs de petites molécules de ces enzymes, en particulier les inhibiteurs de kinases, ont révolutionné le traitement des tumeurs. En principe, les phosphatases constituent également des cibles médicamenteuses prometteuses, mais il a été difficile de s'attaquer à ce groupe d'enzymes à l'aide de petites molécules. Une équipe de recherche dirigée par Christof Hauck, professeur de biologie cellulaire, a identifié un inhibiteur spécifique de la protéine phosphatase PPM1F. Cette enzyme étant un facilitateur clé de la motilité cellulaire, les cellules traitées avec l'inhibiteur sont incapables de se déplacer, ce qui fait que les cellules tumorales restent bloquées sur place.
Jusqu'à présent, le développement d'inhibiteurs spécifiques pour les protéines phosphatases a été un défi pour les biochimistes. Cela est dû, au moins en partie, au centre réactif peu profond et sans prétention de la plupart des protéines phosphatases, qui ne fournit pas une interface de liaison proéminente pour les inhibiteurs. Par conséquent, la meilleure chance de bloquer l'activité d'une phosphatase spécifique vient des inhibiteurs qui influencent l'enzyme à distance, appelés inhibiteurs allostériques. Cependant, trouver un tel agent est difficile, comme la recherche de l'aiguille proverbiale dans la botte de foin.
Repousser le hasard en augmentant les chiffres
Pour trouver un composé possédant ces propriétés particulières, Tanja Grimm, chercheuse doctorale dans l'équipe du professeur Hauck et membre de l'école de recherche en biologie chimique de Constance, a fait équipe avec le centre de criblage du département de biologie. L'objectif était de passer de tests biochimiques laborieux de l'activité enzymatique à une procédure automatisée à l'échelle microscopique. Tanja Grimm et le Centre de criblage ont effectivement pu tester plus de 55 000 composés, développer un algorithme chimio-informatique pour identifier les principales substances à succès, réévaluer 200 candidats à plusieurs reprises, pour aboutir à une poignée d'inhibiteurs potentiels de la PPM1F.
Bien que ces molécules aient toutes été capables de bloquer l'enzyme purifiée, un seul composé était sélectif pour la PPM1F, tandis que les autres présentaient une activité inhibitrice indésirable pour d'autres enzymes. Malheureusement, l'inhibiteur sélectif de la PPM1F présentait également un inconvénient : Il possédait des groupes polaires, ce qui rendait le passage à travers la membrane de la cellule problématique, de sorte que l'inhibiteur pouvait difficilement atteindre l'enzyme cible à l'intérieur de la cellule. Pour résoudre ce problème, Tanja Grimm s'est associée à un collègue du département de chimie pour synthétiser une version modifiée du composé, qu'elle a ensuite pu appliquer à des cellules intactes.
Arrêter les cellules tumorales sur le champ
Comme PPM1F est souvent surexprimé dans les tumeurs malignes, l'étape suivante consistait clairement à tester l'activité de l'inhibiteur de PPM1F dans des cellules cancéreuses humaines. Auparavant, il a été démontré que la délétion du gène PPM1F (en corrompant la séquence d'ADN codant pour la protéine) conduit à des cellules immobiles. En effet, l'application de l'inhibiteur a provoqué un phénotype similaire : Les cellules tumorales se sont fermement collées au substrat et ont cessé de se déplacer. À la lumière de cette propriété frappante, les chercheurs ont rebaptisé leur nouvel inhibiteur "Lockdown", car il bloque essentiellement la forte motilité de ces cellules tumorales.
L'équipe a ensuite testé si Lockdown pouvait également empêcher les cellules tumorales de migrer à travers les barrières tissulaires, un processus appelé invasion des cellules tumorales. L'invasion des cellules tumorales est liée à la capacité des cellules tumorales à former des métastases sur des sites distants dans le corps, ce qui est l'une des principales caractéristiques des cellules malignes. Il est important de noter que l'application de Lockdown a permis d'empêcher les cellules de glioblastome humain, une forme très invasive de cellules tumorales cérébrales, de traverser les barrières tissulaires et de pénétrer dans les tissus sains. En conséquence, des substances telles que Lockdown pourraient servir de point de départ au développement d'agents bloquant les métastases.
Les substrats de PPM1F sont essentiels à l'invasion des cellules tumorales
La possibilité de contrôler la PPM1F par inhibition chimique ouvre également une nouvelle voie pour l'étude de cette enzyme intéressante. Apparemment, les substrats de la PPM1F doivent être des régulateurs critiques de la motilité et de l'invasion des cellules tumorales. Les chercheurs espèrent maintenant que leurs travaux permettront de décoder tous ces substrats en aval afin d'identifier des cibles supplémentaires pour de futurs bloqueurs de métastases. "C'est peut-être encore un rêve lointain, mais être capable de stopper les métastases tumorales représenterait un progrès majeur, en particulier dans les situations où la tumeur primaire peut être enlevée chirurgicalement, mais où l'apparition de métastases serait sinon une épée de Damoclès au-dessus des patients", déclare Tanja Grimm, premier auteur de l'étude.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.