Biocatalizador estable al calor y al oxígeno para la producción de hidrógeno
La [FeFe]-hidrogenasa recientemente detectada en una bacteria termófila no es degradada por el oxígeno
En ausencia de aire, los microorganismos producen hidrógeno utilizando una enzima llamada [FeFe]-hidrogenasa, uno de los biocatalizadores productores de hidrógeno más eficientes que se conocen y una herramienta prometedora para la energía verde del hidrógeno. Sin embargo, estas enzimas se destruyen rápidamente cuando se exponen al aire, lo que ha limitado hasta ahora su uso industrial. Científicos del grupo de Fotobiotecnología y del Centro de Química Teórica de la Universidad del Ruhr de Bochum (Alemania) han aislado un nuevo tipo de [FeFe]-hidrogenasa estable al oxígeno y han descubierto sus "trucos" para conseguirlo. Los resultados se publican en "Journal of American Chemical Society" el 23 de abril de 2025.
Una selección de bacterias termófilas
En la búsqueda de [FeFe]-hidrogenasas altamente estables, el equipo comenzó a buscar [FeFe]-hidrogenasas de bacterias termófilas. Utilizando herramientas bioinformáticas, descubrieron la bacteria termófila Thermosediminibacter oceani, que prospera en torno a los 70˚C y posee una [FeFe]-hidrogenasa potencialmente interesante.
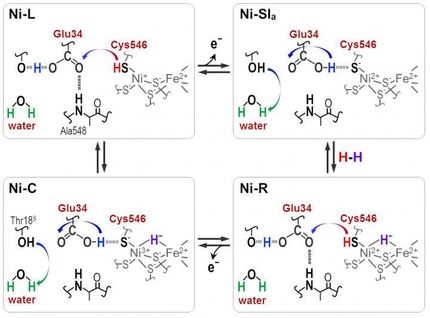
Comprender la elevada estabilidad al oxígeno
Tras producir y aislar con éxito esta nueva [FeFe]-hidrogenasa, observaron su buena termoestabilidad y su estabilidad al oxígeno sin precedentes: sobrevive incluso tras varios días de exposición al aire. "Es muy emocionante ver esta gran estabilidad", afirma Subhasri Ghosh, primer autor del estudio. Mediante mediciones de la producción de hidrógeno, espectroscopia, mutagénesis dirigida al lugar y predicción de estructuras basada en aprendizaje automático, junto con simulaciones informáticas de dinámica molecular, los investigadores obtuvieron información detallada sobre el mecanismo de protección frente al oxígeno. Descubrieron que un aminoácido adicional con azufre situado cerca del centro catalítico es crucial para la estabilidad del oxígeno. "Además, un grupo de aminoácidos hidrófobos influye en la dinámica de la proteína y ayuda a regular la resistencia al oxígeno", afirma el profesor Lars Schäfer. "Estamos seguros de que algunos de estos descubrimientos pueden aplicarse a otras [FeFe]-hidrogenasas y posiblemente ayudar a diseñar [FeFe]-hidrogenasas más estables al oxígeno", concluye el profesor Thomas Happe, del grupo de Fotobiotecnología de la Universidad del Ruhr de Bochum, que dirigió el estudio.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
Subhasri Ghosh, Chandan K. Das, Sarmila Uddin, Sven T. Stripp, Vera Engelbrecht, Martin Winkler, Silke Leimkühler, Claudia Brocks, Jifu Duan, Lars V. Schäfer, Thomas Happe; "Protein Dynamics Affect O2-Stability of Group B [FeFe]-Hydrogenase from Thermosediminibacter oceani"; Journal of the American Chemical Society, Volume 147, 2025-4-23