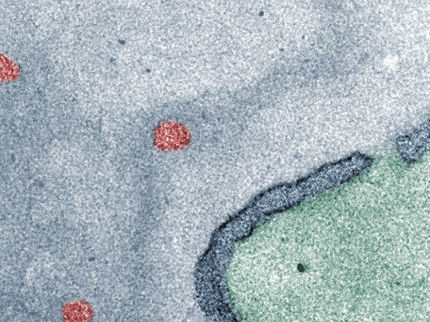
Las nanopartículas de interés médico se mueven en las células más rápido de lo esperado
El hallazgo tiene grandes implicaciones para aplicaciones en nanomedicina como la administración selectiva de fármacos y los estudios intracelulares
Un experimento dirigido por un equipo de científicos del DESY y la Universidad de Hamburgo ha descubierto que las nanopartículas de oro pueden desplazarse por la materia biológica líquida más rápidamente de lo esperado cuando están recubiertas por el polímero polietilenglicol (PEG). Los datos del equipo, obtenidos mediante espectroscopia de correlación de fotones de rayos X, revelan tanto la estructura como la dinámica de las nanopartículas en diversos fluidos biológicos con alta resolución temporal. La investigación se ha publicado en la revista Aggregate.
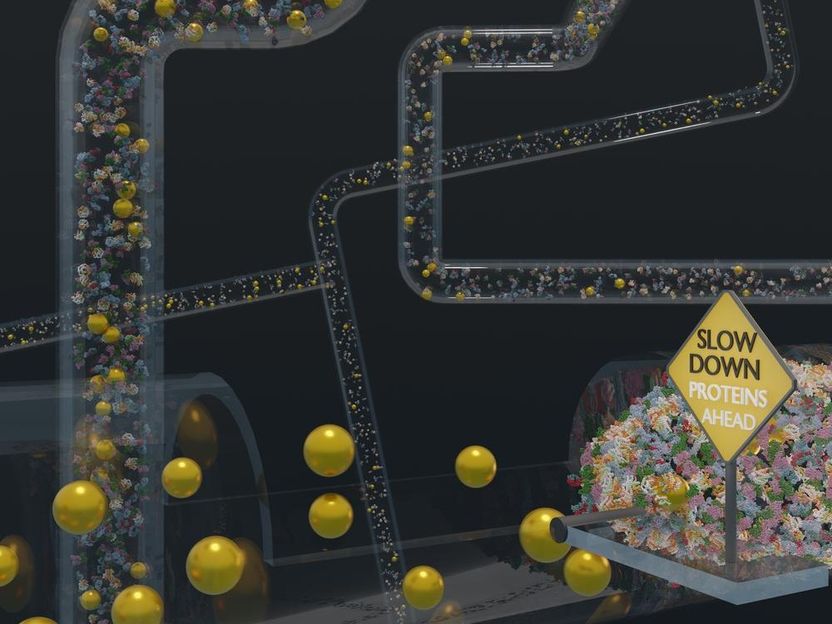
Para ilustrar el tipo de entornos en los que pueden utilizarse las nanopartículas de oro, éstas se acercan a regiones densamente empaquetadas de proteínas. Los investigadores de este estudio descubrieron que las nanopartículas, cuando se recubren con el polímero PEG, se mueven con rapidez por esos entornos densamente empaquetados.
Ferdinand Otto, UHH
En el campo de la nanomedicina, en constante expansión, las nanopartículas de oro se han convertido en una herramienta prometedora. Las nanopartículas son diminutos cristales de oro rodeados de moléculas orgánicas, denominadas ligandos. El recubrimiento de las nanopartículas de oro con dichos ligandos puede controlarse con precisión. Además, el oro no es tóxico, y las nanopartículas de oro tienen propiedades físicas útiles, como una fuerte absorción y dispersión de la luz visible y los rayos X. Esto hace que las nanopartículas de oro sean más resistentes a la radiación. Esto hace que las nanopartículas de oro sean muy útiles para aplicaciones médicas. Se utilizaron ampliamente en la pandemia COVID-19 como ingrediente clave de los cartuchos de autodiagnóstico utilizados en todo el mundo. También muestran un gran potencial para la administración selectiva de fármacos, como agentes de contraste para tomografía computarizada y para enfoques terapéuticos hipertermales, entre otros. Por ejemplo, como posible tratamiento contra el cáncer, pueden inyectarse en un tumor y sobrecalentarse con láser para destruir las células cancerosas desde el interior.
Muchas nanopartículas aprobadas para aplicaciones médicas, incluidas las nanopartículas lipídicas utilizadas en la mayoría de las vacunas COVID, están recubiertas de PEG para mejorar su estabilidad, solubilidad y distribución en el organismo. Por tanto, es de suma importancia comprender cómo afecta este polímero a la dinámica de las partículas en los fluidos biológicos. Debido a su diminuto tamaño, las nanopartículas pueden llegar a penetrar en las células diana, normalmente una vez rodeadas por un cúmulo de proteínas, presentes en altas concentraciones en la sangre y en densidades aún mayores en el interior de las células. La aglomeración de proteínas no sólo modifica las propiedades de las nanopartículas, de modo que podrían dejar de alcanzar su objetivo, sino que también puede desencadenar una respuesta inmunitaria indeseable. Los recubrimientos de PEG pueden reducir en gran medida esta adsorción indeseada de proteínas, y los científicos suelen hablar de un efecto "sigiloso" proporcionado por el recubrimiento de PEG.
En su estudio, el equipo utilizó nanopartículas de oro con recubrimientos de PEG a medida y estudió su dinámica en presencia de concentraciones variables de proteínas. De este modo, pudieron imitar los distintos entornos que las nanopartículas encuentran en el cuerpo: desde el torrente sanguíneo hasta el interior de las células con concentraciones de proteínas extremadamente altas.
"Cuantas más moléculas introduzcas en el fluido, más denso molecularmente será, más te acercarás a lo que se denomina aglomeración de proteínas, que es lo que ocurre en el cuerpo", explica Felix Lehmkühler, científico del DESY que codirigió la investigación. Lehmkühler compara la aglomeración de proteínas con una gran fiesta en una habitación pequeña: los asistentes a la fiesta están todos muy cerca unos de otros, y alguien -en este caso, la nanopartícula de oro- que intenta pasar tiene que cambiar continuamente de dirección o es detenido por alguno de los asistentes a la fiesta en el camino.
"Experimentos anteriores han demostrado sistemáticamente que este proceso de adsorción de proteínas es un efecto común. Queríamos llevar nuestro experimento al extremo de lo posible, a una concentración elevada de proteínas similar a la de la vida real, y comprobar los efectos de una cubierta de PEG", explica Florian Schulz, postdoctorando de la Universidad de Hamburgo que codirigió el experimento con Lehmkühler. "Habríamos esperado ver que las nanopartículas se ralentizan cuando entran en entornos ricos en proteínas".
Sin embargo, el equipo descubrió algo muy distinto en sus resultados. "Cuando entramos en esta situación de aglomeración de proteínas, descubrimos que la partícula se mueve más rápido de lo esperado", afirma Lehmkühler. Parece como si la nanopartícula atravesara velozmente la fiesta de la analogía anterior". El equipo utilizó espectroscopia de correlación de fotones de rayos X para controlar la difusión de las nanopartículas. No observaron indicios de adsorción de proteínas a las nanopartículas a medida que se desplazaban, confirmando así el beneficioso efecto "sigiloso" de los recubrimientos de PEG.
En entornos proteicos muy abarrotados, similares a la situación en las células, las nanopartículas se difunden mucho más rápido de lo que permitiría la viscosidad prevista por la teoría. Y lo que es aún más fascinante, el equipo descubrió que las viscosidades de las soluciones biológicas ricas en proteínas son exactamente las esperadas cuando se miden con métodos clásicos. Como resultado, la viscosidad local de la nanopartícula difiere en gran medida de la viscosidad del material biológico en su conjunto, lo que significa que la nanopartícula tiene un fuerte efecto en su entorno que permite este movimiento rápido. Se trata de un hallazgo de enorme importancia para comprender la dinámica de las nanopartículas en sistemas biológicos, lo que resulta clave para su aplicación segura y satisfactoria.
"Los cambios de viscosidad a nanoescala fueron una sorpresa", afirma Schulz. "Es la primera vez que se observa este fenómeno. Tuvimos que comprobarlo una y otra vez para asegurarnos de que este efecto era real. Es un hallazgo realmente importante, porque nos dice que estas nanopartículas se difunden tan rápidamente porque afectan fuertemente a su entorno local."
"Este estudio subraya lo importante que son estas mediciones minuciosas de la estructura y la dinámica para nuestra comprensión de los sistemas complejos", afirma Ferdinand Otto, primer autor de la publicación, "y la espectroscopia de correlación de fotones de rayos X es un método excelente que apenas está empezando a explorarse en este contexto."
El experimento se realizó en la Instalación Europea de Radiación Sincrotrón (ESRF) de Grenoble (Francia). Sin embargo, este tipo de investigación se beneficiará enormemente de la fuente de luz PETRA IV prevista en el DESY. La técnica utilizada en esta investigación, la espectroscopia de correlación de fotones de rayos X, será la que más se beneficie de la mejora de las instalaciones, ya que la brillantez de PETRA IV permitirá ampliar la escala de tiempo accesible a nanosegundos, o una milmillonésima de segundo.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.