Poner en marcha las fábricas de proteínas - Cómo las enzimas deubiquitinadoras pluriemplean a las proteasas Fubi
Investigadores del Max Planck identifican los mecanismos de los actores clave en el proceso de maduración de los ribosomas con un kit de herramientas de biología química
La pequeña proteína ubiquitina es especialmente famosa por marcar proteínas para su degradación, pero también se ha demostrado que regula prácticamente todos los procesos celulares. Paralelamente al sistema de la ubiquitina han evolucionado otros modificadores similares a la ubiquitina, de los cuales el Fubi está especialmente poco estudiado a pesar de su actividad inmunomoduladora. Científicos del entorno de Malte Gersch, jefe del grupo de investigación del Centro de Genómica Química del Instituto Max Planck de Fisiología Molecular, han obtenido ahora los primeros conocimientos moleculares sobre la maquinaria que facilita la maduración controlada por Fubi de una proteína clave del ribosoma, la fábrica de proteínas de la célula. Con la ayuda de un conjunto de herramientas químicas de nuevo desarrollo, los investigadores han caracterizado cómo dos enzimas deubiquitinadoras proporcionan una actividad hidrolasa Fubi específica y, por tanto, actúan como proteasas Fubi en dos niveles.
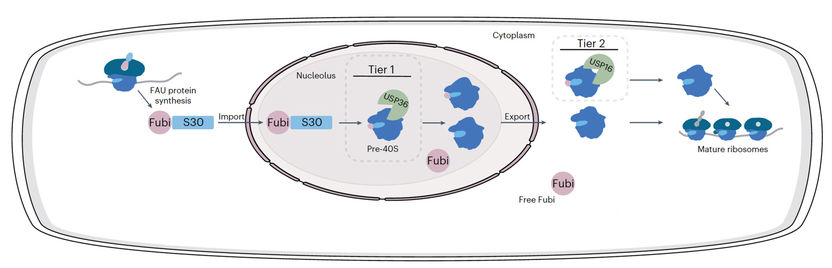
Representación esquemática de la propuesta de procesamiento en dos niveles de Fubi-S30 y el sistema Fubi.
MPI für molekulare Physiologie
El Fubi es producido por las células como una proteína de fusión con la proteína ribosómica S30, y debe ser separado del S30 por proteasas para que los ribosomas funcionen. En las células inmunitarias, este subproducto de la producción de ribosomas se utiliza como molécula de señalización secretada, por ejemplo para reducir localmente la actividad del sistema inmunitario materno en el útero y permitir así la implantación de los embriones. Hasta ahora se desconocía cómo las proteasas reconocen específicamente la Fubi y cómo la distinguen de la ubiquitina.
Rachel O'Dea, primera autora, y Malte Gersch explican en detalle su investigación:
¿Cuál es el descubrimiento que han hecho y por qué es emocionante?
"Nuestro equipo reveló cómo dos enzimas deubiquitinadoras pueden actuar también como proteasas de la proteína Fubi, similar a la ubiquitina, y obtuvo conocimientos moleculares sobre cómo esto es posible de manera específica. Esto es digno de mención porque, a pesar de la similitud entre la ubiquitina y las proteínas similares a la ubiquitina, las enzimas que las regulan en humanos no suelen ser las mismas. Demostramos que esta actividad dual es específica de las dos enzimas USP16 y USP36 y nuestros estudios de cristalografía explican mecánicamente cómo se consigue esta rara reactividad cruzada. Sorprendentemente, a diferencia de lo que se observa en las enzimas de reactividad cruzada de bacterias o virus, no encontramos ningún elemento estructural adicional que facilite la actividad Fubi adicional de estas proteasas de ubiquitina bien caracterizadas. En su lugar, el reconocimiento de Fubi está mediado por un pequeño motivo críptico en una superficie de unión complementaria".
¿Qué tiene de especial el conjunto de herramientas que ha desarrollado?
"Posiblemente debido a su difícil composición aminoacídica, las herramientas de la proteína Fubi aún no se habían añadido al repertorio de herramientas para estudiar la ubiquitina y las proteínas similares a la ubiquitina. Nuestro trabajo demuestra métodos sencillos para fabricar herramientas Fubi que pueden ser fácilmente adaptadas por otros científicos en este campo". Las sondas y el sustrato fluorescente Fubi descritos aquí proporcionan un medio para evaluar la actividad borradora de Fubi tanto en entornos celulares como in vitro."
¿Por qué es importante su investigación para la comunidad científica?
"Nuestro trabajo proporciona nuevos conocimientos moleculares sobre cómo las enzimas pueden tener actividades que abarcan múltiples sistemas de modificación. Explicar cómo USP16 y USP36 desempeñan un papel en la maduración de las proteínas ribosómicas amplía nuestra comprensión de los mecanismos que regulan este proceso celular crítico". La Fubi ha sido estudiada principalmente por científicos del campo de la inmunología, y más recientemente del campo de los ribosomas, y nuestro trabajo abordando el tema con el trasfondo de la ubiquitina complementa estos otros trabajos. Juntos, todos los datos convergen en un modelo de dos niveles para el procesamiento de Fubi".
¿Por qué su investigación es importante para la sociedad?
"Debido a su naturaleza rápida y reversible, las modificaciones postraduccionales como la Ubiquitina y las proteínas similares a la Ubiquitina son reguladores críticos de prácticamente todos los procesos celulares. La Fubi se ha relacionado con funciones inmunomoduladoras y se ha demostrado que modifica proteínas durante respuestas de estimulación inmunitaria. Comprender el papel exacto de Fubi en este proceso ampliará nuestra comprensión del modo en que las células responden a la señalización inmunitaria".
¿Cuáles son los próximos pasos que van a dar?
"Nuestros conocimientos sobre el reconocimiento de Fubi permiten ajustar la actividad de la proteasa Fubi en las células y, por tanto, están allanando el camino para comprender mejor el papel celular de esta enigmática proteína como modificación postraduccional. Además, estamos utilizando las sondas para facilitar la investigación del mecanismo molecular por el que otras proteínas interactúan con Fubi. Pero antes vamos a celebrarlo".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.





















































