La estructura de la enzima "devoradora de petróleo" abre la puerta a los catalizadores de bioingeniería
Detalles a nivel atómico revelan cómo la enzima rompe selectivamente enlaces de hidrocarburos, lo que sugiere estrategias de bioingeniería para fabricar sustancias químicas útiles
Científicos del Laboratorio Nacional Brookhaven del Departamento de Energía de EE.UU. han creado la primera estructura a nivel atómico de una enzima que corta selectivamente los enlaces carbono-hidrógeno, el primer paso y el más difícil en la transformación de hidrocarburos simples en sustancias químicas más útiles. Como se describe en un artículo publicado en Nature Structural & Molecular Biology, el detallado "plano" a nivel atómico sugiere formas de diseñar la enzima para producir los productos deseados.
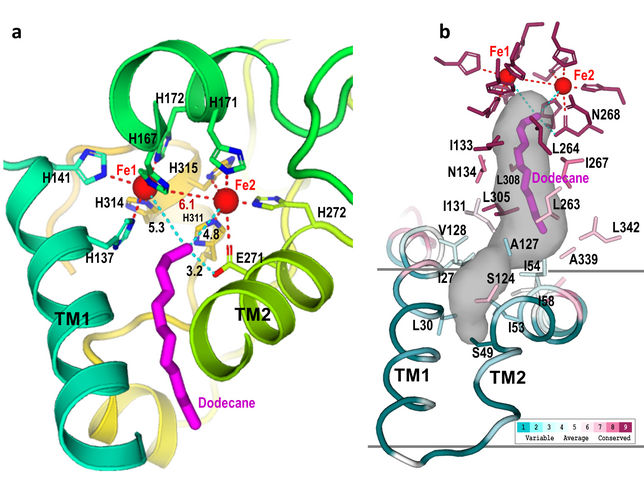
Sitio activo: Estos primeros planos del sitio activo de AlkB muestran cómo nueve aminoácidos histidina (indicados como "H" en la imagen de la izquierda) forman una cavidad (región sombreada en gris, derecha). Esta cavidad guía el sustrato (magenta) hacia el sitio activo (cerca de los dos átomos de hierro, Fe) en una única orientación, donde sólo puede romperse el enlace carbono-hidrógeno terminal. La modificación de la enzima para cambiar la forma de esta cavidad podría permitir que la enzima atacara diferentes enlaces C-H.
Brookhaven National Laboratory
"Queremos crear un conjunto diverso de biocatalizadores en los que se pueda seleccionar específicamente el sustrato deseado para obtener productos únicos y deseados a partir de hidrocarburos abundantes", explica Qun Liu, biólogo estructural del Laboratorio Brookhaven y codirector del estudio. "El planteamiento nos daría una forma controlable de convertir alcanos baratos y abundantes -compuestos simples de carbono e hidrógeno que constituyen entre el 20 y el 50 por ciento del petróleo crudo- en bioproductos o precursores químicos más valiosos, como alcoholes, aldehídos, carboxilatos y epóxidos".
La idea es especialmente atractiva porque la mayoría de los procesos catalíticos industriales utilizados para la conversión de alcanos producen subproductos no deseados y gas dióxido de carbono (CO2) que atrapa el calor. Además, contienen materiales costosos y requieren altas temperaturas y presiones. La enzima biológica, conocida como AlkB, funciona en condiciones más ordinarias y con una especificidad muy elevada. Utiliza hierro barato y abundante en la Tierra para iniciar la química y produce pocos subproductos no deseados.
"La naturaleza ha descubierto cómo hacer este tipo de química con un metal abundante y barato y a temperatura y presiones ambientales", afirma John Shanklin, director del Departamento de Biología del Laboratorio Brookhaven y autor principal del artículo. "Como resultado, ha habido un interés masivo en esta enzima, pero una falta total de comprensión de su arquitectura y cómo funciona, lo cual es necesario para su reingeniería para nuevos fines. Con esta estructura, hemos superado este obstáculo".
Del aceite rancio al dulce éxito
AlkB se descubrió hace 50 años en un taller mecánico, donde las bacterias digerían el aceite refrigerante haciéndolo oler a rancio. Los bioquímicos descubrieron la enzima bacteriana AlkB como el factor que permitía el apetito inusual de los microbios. Desde entonces, los científicos se han interesado por aprovechar la capacidad de AlkB para masticar hidrocarburos.
A lo largo de los años, los estudios revelaron que la enzima se encuentra parcialmente incrustada en las membranas de las bacterias y que actúa en conjunción con otras dos proteínas. Shanklin y Liu -y otros científicos- intentaron resolver la estructura de la enzima mediante cristalografía de rayos X. Este método consiste en hacer rebotar rayos X de alta intensidad sobre la estructura de la enzima. Este método hace rebotar rayos X de alta intensidad en una versión cristalizada de una proteína para identificar dónde están los átomos. Pero las proteínas de membrana como la AlkB son notoriamente difíciles de cristalizar, especialmente cuando forman parte de un complejo multiproteico.
"No podíamos obtener una resolución lo suficientemente alta", afirma Liu.
Entonces, a principios de 2021, Brookhaven inauguró su nueva instalación de criomicroscopía electrónica (crioEM), el Laboratorio de Estructura Biomolecular (LBMS). Los científicos utilizaron un crio-EM, que no requiere una muestra cristalizada, para tomar imágenes de unos pocos millones de moléculas individuales de proteínas congeladas desde muchos ángulos diferentes. A continuación, las herramientas informáticas clasificaron las imágenes, identificaron y promediaron las características comunes y, finalmente, generaron un mapa tridimensional de alta resolución del complejo enzimático. A partir de este mapa, los científicos reconstruyeron las estructuras atómicas conocidas de los aminoácidos individuales que componen el complejo proteico para completar los detalles en tres dimensiones.
Identificar las condiciones adecuadas para estabilizar la región transmembrana de la enzima y mantener los detalles estructurales fue un reto que requirió mucho ensayo y error. Shanklin da crédito a Jin Chai, uno de los investigadores de su laboratorio, "por su compromiso y determinación para resolver este rompecabezas".
La estructura revela cómo funciona la enzima
La estructura detallada muestra exactamente cómo AlkB y una de las dos proteínas asociadas (AlkG) trabajan juntas para escindir los enlaces carbono-hidrógeno. De hecho, la estructura resuelta contenía un extra inesperado: una molécula de alcano sustrato que estaba atrapada en la cavidad del sitio activo de la enzima.
"Nuestra estructura muestra cómo los aminoácidos que componen esta enzima forman una cavidad que orienta el hidrocarburo sustrato de modo que sólo un enlace carbono-hidrógeno específico pueda acercarse al sitio activo", explicó Liu. "También muestra cómo los electrones se mueven desde la proteína portadora (AlkG) hasta el centro de hierro di en el sitio activo de la enzima, lo que le permite activar una molécula de oxígeno para atacar este enlace".
Shanklin sugiere pensar en la enzima como una máquina de cortar enlaces, como una sierra circular: "La forma de sujetar el alcano con respecto al centro de hierro dieléctrico de la enzima determina cómo interactúa el oxígeno activado con el hidrocarburo. Si diriges el extremo del alcano contra el oxígeno activado, se va a iniciar cierta química en ese último carbono".
"La ingeniería que queremos hacer es cambiar la forma de la cavidad del sitio activo para que podamos hacer que el sustrato (o un sustrato diferente) se acerque al oxígeno activado en diferentes ángulos y en diferentes ubicaciones de enlace C-H para realizar diferentes reacciones".
En la naturaleza, señalaron los científicos, una tercera proteína no incluida en esta estructura (AlkT) proporciona los electrones a AlkG, la proteína portadora. A continuación, la proteína portadora transporta los electrones a los dos átomos de hierro que activan el oxígeno en el sitio activo de AlkB. Sustituir esa proteína donadora de electrones por un electrodo para suministrar electrones sería más sencillo y menos costoso que utilizar el donante biológico de electrones, sugieren.
El DOE acaba de financiar la propuesta del equipo para desarrollar estos "catalizadores biohíbridos transformadores de dihierro para la funcionalización de enlaces C-H", basada en parte en este trabajo estructural preliminar.
"Esta estructura y nuestros conocimientos sobre el funcionamiento del complejo AlkG/AlkB nos sitúan en una posición inmejorable para aplicar bioingeniería a esta enzima con el fin de seleccionar qué enlace carbono-hidrógeno se activa en diversos sustratos y controlar los electrones y el oxígeno para rediseñar su selectividad", afirma Liu.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.





















































