Estructura atómica de un bacteriófago estafilocócico mediante criomicroscopía electrónica expuesta
La criomicroscopía electrónica realizada por investigadores de la Universidad de Alabama en Birmingham ha puesto al descubierto la estructura de un virus bacteriano con un detalle sin precedentes. Se trata de la primera estructura de un virus capaz de infectar a Staphylococcus epidermidis, y el conocimiento de alta resolución de la estructura es un eslabón clave entre la biología vírica y el posible uso terapéutico del virus para sofocar infecciones bacterianas.
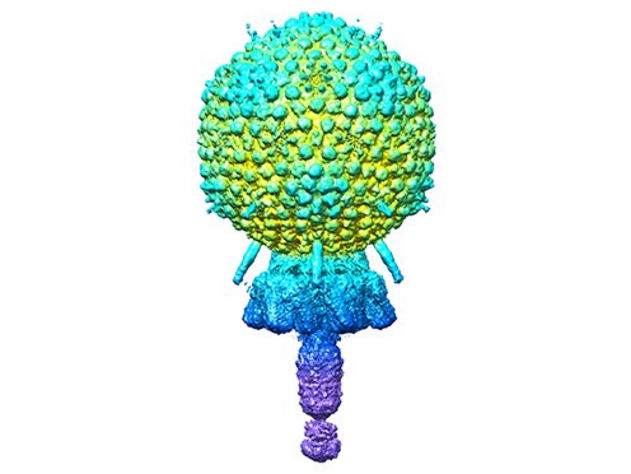
El fago de Andhra
UAB, Dokland lab
Bacteriófagos o "fagos" es el término utilizado para los virus que infectan bacterias. Los investigadores de la UAB, dirigidos por el doctor Terje Dokland, en colaboración con la doctora Asma Hatoum-Aslan, de la Universidad de Illinois Urbana-Champaign, han descrito modelos atómicos para la totalidad o parte de 11 proteínas estructurales diferentes del fago Andhra. El estudio se publica en Science Advances.
Andhra pertenece al grupo de los picovirus. Su gama de huéspedes se limita a S. epidermidis. Esta bacteria cutánea es benigna en la mayoría de los casos, pero también es una de las principales causas de infecciones de dispositivos médicos permanentes. "Los picovirus rara vez se encuentran en las colecciones de fagos y siguen estando poco estudiados e infrautilizados para aplicaciones terapéuticas", explica Hatoum-Aslan, biólogo especialista en fagos de la Universidad de Illinois.
Con la aparición de la resistencia a los antibióticos en S. epidermidis y el patógeno relacionado Staphylococcus aureus, los investigadores han renovado el interés por el posible uso de bacteriófagos para tratar infecciones bacterianas. Los picovirus siempre matan a las células que infectan, después de unirse a la pared celular bacteriana, romper enzimáticamente esa pared, penetrar en la membrana celular e inyectar ADN viral en la célula. También tienen otras características que las convierten en candidatas atractivas para uso terapéutico, como un genoma pequeño y la incapacidad de transferir genes bacterianos entre bacterias.
El conocimiento de la estructura proteínica de Andhra y la comprensión de cómo esas estructuras permiten al virus infectar una bacteria permitirán producir fagos a medida, adaptados a un fin específico, mediante manipulación genética.
"La base estructural de la especificidad de hospedador entre los fagos que infectan S. aureus y S. epidermidis aún no se conoce bien", afirma Dokland, catedrático de Microbiología de la UAB y director del Núcleo de Microscopía Crioelectrónica de la UAB. "Con el presente estudio, hemos logrado una mejor comprensión de las estructuras y funciones de los productos génicos Andhra y de los determinantes de la especificidad del huésped, allanando el camino para un diseño más racional de fagos personalizados para aplicaciones terapéuticas. Nuestros hallazgos dilucidan características críticas para el ensamblaje del virión, el reconocimiento del huésped y la penetración".
Los fagos estafilocócicos suelen tener un estrecho rango de bacterias a las que pueden infectar, dependiendo de los polímeros variables del ácido teicoico de la pared en la superficie de las distintas cepas bacterianas. "Esta estrecha gama de huéspedes es un arma de doble filo: Por un lado, permite que los fagos se dirijan únicamente al patógeno específico causante de la enfermedad; por otro, significa que el fago puede tener que adaptarse al paciente en cada caso concreto", afirma Dokland.
La estructura general de Andhra es una cabeza de cápside icosaédrica redondeada de 20 caras que contiene el genoma vírico. La cápside está unida a una cola corta. La cola es en gran parte responsable de unirse a S. epidermidis y romper enzimáticamente la pared celular. El ADN viral se inyecta en la bacteria a través de la cola. Los segmentos de la cola incluyen el portal de la cápside a la cola, y el tallo, los apéndices, el pomo y la punta de la cola.
Las 11 proteínas diferentes que componen cada partícula vírica se encuentran en múltiples copias que se ensamblan entre sí. Por ejemplo, la cápside está formada por 235 copias cada una de dos proteínas, y las otras nueve proteínas del virión tienen un número de copias de dos a 72. En total, el virión está formado por 645 piezas proteicas que incluyen dos copias de una duodécima proteína, cuya estructura se predijo utilizando el programa de predicción de estructuras proteicas AlphaFold.
Los modelos atómicos descritos por Dokland, Hatoum-Aslan y los co-primeros autores N'Toia C. Hawkins, Ph.D., y James L. Kizziah, Ph.D., del Departamento de Microbiología de la UAB, muestran las estructuras de cada proteína, descritas en lenguaje molecular como alfa-hélice, beta-hélice, beta-cadena, beta-barril o beta-prisma. Los investigadores han descrito cómo cada proteína se une a otras copias de ese mismo tipo de proteína, por ejemplo para formar las caras hexamérica y pentamérica de la cápside, así como el modo en que cada proteína interactúa con los distintos tipos de proteínas adyacentes.
Los microscopios electrónicos utilizan un haz de electrones acelerados para iluminar un objeto, proporcionando una resolución mucho mayor que un microscopio óptico. La criomicroscopía electrónica añade el elemento de las temperaturas superfrías, lo que la hace especialmente útil para la resolución de estructuras casi atómicas de proteínas más grandes, proteínas de membrana o muestras que contienen lípidos, como receptores unidos a membranas, y complejos de varias biomoléculas juntas.
En los últimos ocho años, los nuevos detectores de electrones han supuesto un enorme salto en la resolución de la criomicroscopía electrónica con respecto a la microscopía electrónica normal. Los elementos clave de esta llamada "revolución de la resolución" para la criomicroscopía electrónica son:
- Congelación rápida de muestras acuosas en etano líquido enfriado a menos de -256 grados F. En lugar de cristales de hielo que alteran las muestras y dispersan el haz de electrones, el agua se congela hasta formar un "hielo vítreo" similar a una ventana.
- La muestra se mantiene a temperaturas superfrías en el microscopio y se utiliza una dosis baja de electrones para evitar dañar las proteínas.
- Los rapidísimos detectores de electrones directos son capaces de contar átomos individuales a cientos de fotogramas por segundo, lo que permite corregir el movimiento de la muestra sobre la marcha.
- La informática avanzada fusiona miles de imágenes para generar estructuras tridimensionales de alta resolución. Se utilizan unidades de procesamiento gráfico para procesar terabytes de datos.
- La platina del microscopio que sostiene la muestra también puede inclinarse a medida que se toman las imágenes, lo que permite construir una imagen tomográfica tridimensional, similar a una tomografía computarizada en el hospital.
El análisis de la estructura del virión Andhra realizado por los investigadores de la UAB comenzó con 230.714 imágenes de partículas. La reconstrucción molecular de la cápside, la cola, la cola distal y la punta de la cola comenzó con 186.542, 159.489, 159.489 y 159.489 imágenes, respectivamente. La resolución oscilaba entre 3,50 y 4,90 angstroms.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.