Desvelada la estructura molecular de uno de los receptores más importantes del sistema inmunitario
Investigadores publican la estructura tridimensional del receptor de antígeno de células B, arrojando nueva luz sobre su composición
La superficie de los linfocitos B está cubierta de receptores de antígenos con los que reconocen a los patógenos invasores, como las bacterias y los virus. Cuando un receptor de células B se une a un antígeno, es decir, a una estructura extraña, la célula B se activa y desencadena la producción de anticuerpos. Los anticuerpos son esenciales para nuestra supervivencia y nos protegen contra enfermedades graves derivadas de infecciones con patógenos como el COVID-19. Las vacunas tienen un efecto protector, ya que activan los receptores de antígenos, desencadenando así una respuesta inmunitaria. Un equipo internacional de investigadores del Grupo de Excelencia CIBSS de la Universidad de Friburgo y de la Facultad de Medicina de Harvard (Estados Unidos) ha publicado ahora la estructura molecular exacta de un receptor de células B de tipo IgM. Sus hallazgos indican que el receptor en la superficie de la célula B interactúa con otros receptores, controlando así su transducción de señales. El estudio se ha publicado en la revista Nature.
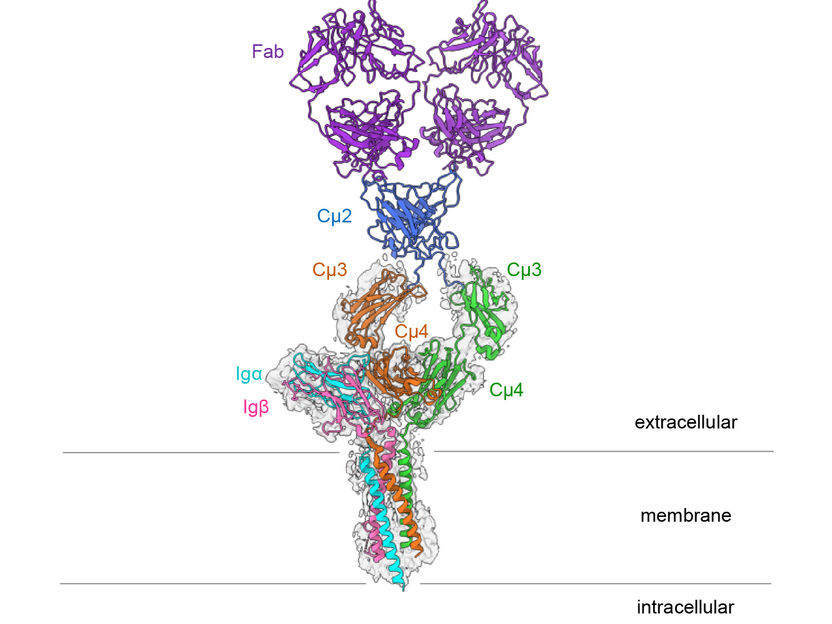
Estructura del receptor de células B IgM del ratón.
Hao Wu/Harvard Medical School
Conexión de las subunidades de señalización con la inmunoglobulina
El receptor de antígenos de las células B está formado por un anticuerpo unido a la membrana celular y dos proteínas más pequeñas, la Ig alfa y la Ig beta. Estas subunidades más pequeñas transmiten señales al interior de la célula en cuanto el receptor de células B identifica un patógeno. "Hasta ahora se desconocía exactamente cómo se conectan estas subunidades de señalización con la inmunoglobulina", afirma el Prof. Dr. Michael Reth, de la Facultad de Biología de la Universidad de Friburgo, que lleva más de 30 años investigando el receptor y descubrió originalmente sus subunidades de señalización. Es miembro del Grupo de Excelencia CIBSS (Centro de Estudios de Señalización Biológica Integral) y codirector del Grupo de Excelencia BIOSS. "Durante mucho tiempo, no tuvimos las posibilidades técnicas para estudiar la estructura exacta de las proteínas de membrana. Ahora, la criomicroscopía electrónica nos ha permitido crear una imagen de alta resolución del receptor de células B", afirma Reth.
Con la criomicroscopía electrónica, la muestra que se va a estudiar se enfría muy rápidamente a 183 °C bajo cero. Esto reduce el movimiento natural de las moléculas y evita la formación de diminutos cristales de hielo que, de otro modo, destruirían la estructura de la proteína. De este modo, es posible alcanzar resoluciones mucho mayores que con otros métodos de microscopía electrónica. En su estudio actual, los investigadores lograron una resolución de 3,3 ångströms, que corresponde a la anchura de unos pocos átomos. Para ello, combinaron cientos de miles de imágenes del receptor completo con las de una versión truncada que carecía de dos regiones flexibles. A continuación, utilizaron estos datos para calcular en el ordenador la estructura tridimensional completa del receptor de células B.
El anticuerpo simétrico unido a la membrana sólo se une a un lado
Lo más sorprendente de la estructura tridimensional es que el anticuerpo simétrico unido a la membrana sólo se une a la Ig alfa y a la Ig beta por un lado, formando así un complejo asimétrico. Esta asimetría se asemeja a la del receptor de células T, otro importante receptor inmunitario cuya estructura se dilucidó por primera vez en 2019. "Es asombroso que ambos tipos de receptores de antígenos formen complejos asimétricos", explica Reth. "Esto nos lleva a concluir que la estructura ahora dilucidada forma parte de un complejo receptor más grande y que interactúa con otras moléculas más en la superficie de las células B".
Este tipo de estructuras más grandes, que se mantienen unidas mediante fuerzas menos potentes, no pueden estudiarse todavía con técnicas como la criomicroscopía electrónica. Sin embargo, la estructura molecular recién publicada aporta más pruebas a favor de esa interacción con otras moléculas: Muestra que el exterior del receptor de células B contiene aminoácidos conservados. Los aminoácidos se describen como conservados si apenas cambian en el curso de la evolución y, por tanto, son idénticos en los receptores de antígenos de diferentes organismos. "La presencia de aminoácidos conservados que se dirigen hacia el exterior sugiere que el receptor de células B IgM tiene más socios de unión", dice Reth. "En otras palabras, hasta ahora sólo conocemos una parte de la máquina, y ahora queremos identificar los otros bloques de construcción y determinar cómo influyen en el efecto de señalización del receptor".
Estos otros componentes podrían explicar por qué el receptor se mantiene normalmente en reposo y sólo se activa cuando se une a un antígeno. "Esa será una de las próximas tareas importantes en el estudio de la inmunidad adaptativa", resume Reth. "Una mejor comprensión de la activación de los linfocitos B también podría ayudarnos a mejorar el desarrollo de vacunas o a entender la formación de linfomas en los que el receptor de los linfocitos B se activa de forma incontrolada".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.





















































