Levantando la tapa de las barrigas beta
La interacción entre la biotina y la estreptavidina es una herramienta experimental bien establecida en la bionanotecnología. Los físicos de la LMU han demostrado ahora que la estabilidad mecánica del complejo depende de la geometría precisa de la interfaz.
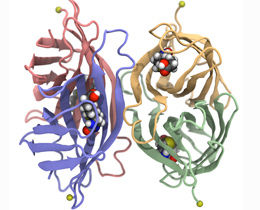
La estreptavidina está compuesta por cuatro subunidades idénticas (mostradas aquí en verde, azul, amarillo y rojo), cada una de las cuales puede unirse a una molécula de biotina (esferas de color). En el experimento, la estreptavidina se fija a un ancla (esfera amarilla) mientras que una molécula de biotina se extrae de una de las bolsas de unión.
Rafael C. Bernardi
Las fuerzas mecánicas desempeñan un papel vital en todos los niveles de los sistemas biológicos. La contracción y relajación de las células musculares es sin duda el mejor ejemplo conocido de ello, pero las proteínas mecanosensibles se encuentran en realidad en prácticamente todas las células. Por ejemplo, el esfuerzo de cizallamiento ejercido por el flujo sanguíneo en las células que recubren los vasos sanguíneos es percibido por los mecanorreceptores, que activan las vías de señalización que controlan el diámetro de los vasos. En sus esfuerzos por comprender los mecanismos moleculares que median tales procesos, los científicos estudian las respuestas de las proteínas mecanosensibles analizando su comportamiento bajo estrés mecánico. Muchos de estos experimentos se basan en el uso de la estrecha y muy específica interacción entre la biotina (una vitamina) y su proteína de unión, la estreptavidina, como indicador de fuerza. En colaboración con Rafael Bernardi en el Instituto Beckman de Urbana (Illinois), los biofísicos de la LMU dirigidos por el profesor Hermann Gaub han realizado ahora un análisis detallado de la estabilidad mecánica de este complejo, que aparece en la revista Science Advances. Sus conclusiones muestran que la geometría de la interfaz entre el ligando y su bolsa de unión en el receptor tiene un marcado impacto en la estabilidad del complejo, y que este factor debe tenerse en cuenta al evaluar los datos experimentales.
Una clavija molecular
Los físicos utilizan una técnica llamada espectroscopia de fuerza de una sola molécula para medir cómo reaccionan las biomoléculas a las fuerzas mecánicas. En este método, la proteína de interés está entre corchetes entre dos marcas moleculares. Una de ellas sirve para unir covalentemente la proteína a un portaobjetos de vidrio. La otra está vinculada a un montaje que permite al experimentador ejercer una fuerza graduada sobre la proteína. A menudo, este segundo enlazador hace uso de la interacción no covalente entre la biotina y la estreptavidina. "Este sistema de enlace-receptor es el 'rawlug' de la espectroscopia de fuerza", dice Steffen Sedlak, un miembro del equipo de Gaub y autor principal del artículo.
La etiqueta de biotina está adherida covalentemente a la propia proteína y por lo tanto está disponible para la unión de alta afinidad a la estreptavidina. La notable estabilidad mecánica de la interacción entre el ligando y su receptor es un factor vital en estos experimentos. Desde los primeros experimentos de espectroscopia de fuerza en este sistema realizados por Gaub hace unos 25 años, las mediciones de la respuesta del complejo a las fuerzas mecánicas se han medido mediante espectroscopia de fuerza en laboratorios de todo el mundo. Sin embargo, los resultados obtenidos en diferentes entornos han sido inconsistentes y han mostrado un rango de variación bastante amplio. El nuevo estudio se propuso determinar las razones de ello.
La proteína estreptavidina está compuesta por cuatro dominios estructuralmente similares, llamados "barritas beta" porque están formadas por filamentos paralelos que están dispuestos como las duelas de un barril. Cada uno de estos barriles puede alojar una molécula de biotina, y como todo barril que se precie, cada uno está equipado con una tapa, que se cierra sobre la biotina ligada. En esta conformación, la biotina es accesible sólo desde el otro extremo - el extremo que está unido a la proteína de interés.
Extraer la biotina de su barril
Para sus experimentos, Sedlak y sus colegas crearon varias variantes mutantes de la proteína estreptavidina. En cada caso, sólo una estructura específica del barril era capaz de unirse a la biotina, mientras que las otras tres permanecían vacías. Para medir la estabilidad de la unión a cada barril individual, el equipo midió las fuerzas requeridas para sacar la biotina unida de las cuatro proteínas de estreptavidina. "Descubrimos que la magnitud de la fuerza requerida para extraer la biotina variaba dependiendo de en cuál de los cuatro barriles se encontraba - aunque las cuatro bolsas de unión activas son exactamente las mismas", explica Gaub.
¿Afuera de la puerta o a través de la pared?
Con la ayuda de complejas simulaciones por ordenador, el equipo fue capaz de averiguar la razón de estos sorprendentes hallazgos. Al ser sometidas a una fuerza mecánica gradualmente creciente, las moléculas de biotina en las diferentes bolsas aparentemente ocupan diferentes posiciones antes de que la fuerza sea lo suficientemente grande como para desplazarlas. Esto a su vez altera la geometría de la aplicación de la fuerza posterior, y este factor puede explicar las diferencias en la respuesta de cada bolsa. La extracción se produce con mayor facilidad cuando la fuerza es capaz de actuar sobre la tapa flexible del barril beta, pero si se ejerce tensión en cualquier otra posición, el sistema puede resistir tensiones mucho mayores. "Como seguramente descubrió el propio Diógenes, es más fácil salir del barril levantando la tapa que aflojando las duelas", dice Sedlak. "Pero el hecho de que este principio también se aplica a la acción de las fuerzas mecánicas en biomoléculas individuales no es en absoluto trivial."
Los autores creen que estos resultados permitirán optimizar la estreptavidina para su uso en experimentos de espectroscopia de fuerza, permitiendo a los experimentadores ajustar la estabilidad de la posición del pasador en el barril.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.