Comienza el ensayo clínico del NIH de remdesivir para tratar el COVID-19
En el Centro Médico de la Universidad de Nebraska (UNMC) en Omaha se ha iniciado un ensayo clínico aleatorio y controlado para evaluar la seguridad y la eficacia del antiviral de investigación remdesivir en adultos hospitalizados a los que se les ha diagnosticado la enfermedad coronavírica 2019 (COVID-19). El patrocinador regulador del ensayo es el Instituto Nacional de Alergia y Enfermedades Infecciosas (NIAID), que forma parte de los Institutos Nacionales de Salud. Este es el primer ensayo clínico en los Estados Unidos para evaluar un tratamiento experimental para Covid-19, la enfermedad respiratoria detectada por primera vez en diciembre de 2019 en Wuhan, provincia de Hubei, China.
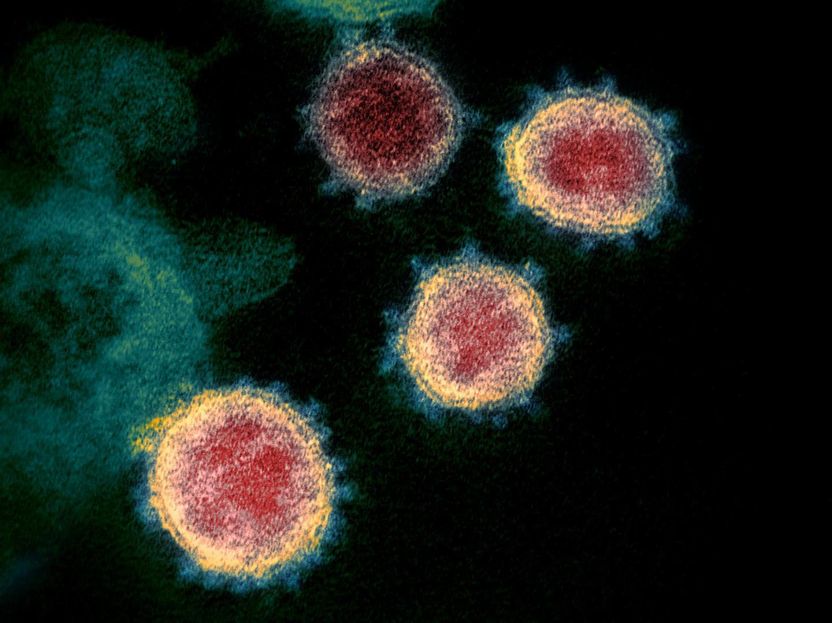
Esta imagen de microscopio electrónico de transmisión muestra el SARS-CoV-2 -también conocido como 2019-nCoV, el virus que causa el COVID-19- aislado de un paciente en los EE.UU. Las partículas del virus se muestran emergiendo de la superficie de las células cultivadas en el laboratorio. Los picos en el borde exterior de las partículas del virus le dan a los coronavirus su nombre, como una corona.
NIAID RML
El primer participante en el ensayo es un estadounidense que fue repatriado después de haber estado en cuarentena en el crucero Diamond Princess que atracó en Yokohama (Japón) y se ofreció como voluntario para participar en el estudio. El estudio puede adaptarse para evaluar tratamientos de investigación adicionales y para inscribir participantes en otros lugares de los Estados Unidos y del mundo.
No existen terapias específicas aprobadas por la Administración de Alimentos y Medicamentos (FDA) para tratar a las personas con COVID-19, la enfermedad causada por el virus recientemente emergente del SARS-CoV-2 (antes conocido como 2019-nCoV). La infección puede causar una enfermedad respiratoria de leve a grave, y los síntomas pueden incluir fiebre, tos y dificultad para respirar. Al 24 de febrero, la Organización Mundial de la Salud (OMS) ha comunicado 77.262 casos confirmados de COVID-19 y 2.595 muertes en China y 2.069 casos de COVID-19 y 23 muertes en otros 29 países. Según los Centros para el Control y la Prevención de Enfermedades (CDC), se han notificado 14 casos confirmados de COVID-19 en los Estados Unidos y otros 39 casos entre personas repatriadas a los Estados Unidos.
Remdesivir, desarrollado por Gilead Sciences Inc., es un tratamiento antiviral de amplio espectro en investigación. Fue previamente probado en humanos con la enfermedad del virus del Ébola y se ha mostrado prometedor en modelos animales para el tratamiento del síndrome respiratorio del Medio Oriente (MERS) y el síndrome respiratorio agudo severo (SARS), que son causados por otros coronavirus.
"Necesitamos urgentemente un tratamiento seguro y efectivo para COVID-19. Aunque se ha administrado remdesivir a algunos pacientes con COVID-19, no tenemos datos sólidos que indiquen que pueda mejorar los resultados clínicos", dijo el director del NIAID y miembro del Grupo de Trabajo sobre el Coronavirus de los Estados Unidos, el Dr. Anthony S. Fauci.
En China también se están realizando ensayos clínicos del remdesivir. El NIAID desarrolló el estudio actual teniendo en cuenta esos diseños, y de conformidad con las consultas convocadas por la OMS sobre el desarrollo de un ensayo terapéutico para pacientes con COVID-19.
Los participantes en el ensayo patrocinado por los Institutos Nacionales de Salud deben tener una infección por SARS-CoV-2 confirmada por el laboratorio y pruebas de afectación pulmonar, incluidos ruidos de traqueteo al respirar (estertores) con necesidad de oxígeno suplementario o radiografías de tórax anormales, o una enfermedad que requiera ventilación mecánica. Los individuos con infección confirmada que tengan síntomas leves, parecidos a los del resfriado o sin síntomas aparentes no serán incluidos en el estudio. De conformidad con los protocolos estándar de investigación clínica, los pacientes que reúnan las condiciones necesarias prestarán un consentimiento informado para participar en el ensayo.
Todos los posibles participantes se someterán a un examen físico de referencia antes de recibir el tratamiento. Los participantes elegibles para el estudio serán asignados al azar al grupo de tratamiento de investigación o al grupo de placebo. El estudio es doble ciego, lo que significa que los investigadores del ensayo y los participantes no sabrían quién está recibiendo el remdesivir o el placebo. Los participantes del grupo de tratamiento en investigación recibirán 200 miligramos (mg) de remdesivir por vía intravenosa el primer día de inscripción en el estudio. Recibirán otros 100 mg. cada día durante la duración de la hospitalización, hasta un total de 10 días. El grupo de placebo recibirá, en un volumen igual, una solución parecida al remdesivir pero que sólo contiene ingredientes inactivos.
Los médicos supervisarán regularmente a los participantes y les asignarán puntuaciones diarias basadas en una escala predefinida de resultados clínicos que tenga en cuenta factores como la temperatura, la presión sanguínea y el uso de oxígeno suplementario, entre otros. También se pedirá a los participantes que proporcionen muestras de sangre y frotis de nariz y garganta aproximadamente cada dos días. Los investigadores analizarán estos especímenes para detectar el SARS-CoV-2.
Inicialmente, los investigadores compararán los resultados de los participantes en el día 15 tanto en el grupo de remdesivir como en el de placebo para ver si el medicamento en investigación aumentó el beneficio clínico en comparación con el placebo. Los resultados se califican en una escala de siete puntos que va desde la recuperación total hasta la muerte. Los investigadores reevaluarán esta escala después de revisar los datos de los primeros 100 participantes.
Una junta independiente de supervisión de datos y seguridad (DSMB) supervisará los resultados continuos para asegurar el bienestar y la seguridad de los pacientes, así como la integridad del estudio. La DSMB recomendará que el estudio se detenga si hay pruebas claras y sustanciales de una diferencia de tratamiento entre el medicamento y el placebo.
El Dr. Andre Kalil, profesor de medicina interna en el UNMC y médico de enfermedades infecciosas en Nebraska Medicine, está dirigiendo el ensayo en el UNMC. Trece personas repatriadas por el Departamento de Estado de los Estados Unidos desde el crucero Diamond Princess fueron transportadas a la Unidad de Cuarentena Nacional, ubicada dentro del Centro de Entrenamiento, Simulación y Cuarentena en el campus de Medicina de UNMC/Nebraska en Omaha el 17 de febrero de 2020. Los pasajeros se encontraban en un entorno cercano donde se había producido una importante propagación de COVID-19 y fueron enviados a la unidad para continuar con el aislamiento y posiblemente recibir más cuidados. Desde entonces, los CDC han informado de que 11 personas de la unidad de la UNMC han confirmado la infección por SARS-CoV-2.
La Unidad de Cuarentena Nacional del UNMC cuenta con el apoyo de la oficina del Subsecretario de Preparación y Respuesta (ASPR) del Departamento de Salud y Servicios Humanos. Tiene una capacidad de 20 camas y está muy cerca de la Unidad de Biocontención de Nebraska, en caso de que se necesite un nivel de cuidado más alto. Los participantes en los ensayos clínicos son atendidos en la unidad de biocontención.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.