Medicamentos con cadenas de azúcar
La espectrometría de masas nativa top-down revela el papel de los glicanos en los oligómeros de proteínas
Muchas proteínas contienen patrones de moléculas de azúcar (glicanos) y están formadas por varias subunidades agregadas. Esta glicosilación y oligomerización tiene una influencia decisiva en la función de las proteínas y debe tenerse en cuenta en el desarrollo biofarmacéutico. En la revista Angewandte Chemie, un equipo británico ha presentado un enfoque basado en la espectroscopia de masas (EM) nativa descendente que puede utilizarse para analizar la interacción entre la glicosilación y la oligomerización en diversas hormonas y citoquinas terapéuticas.
(c) Wiley-VCH
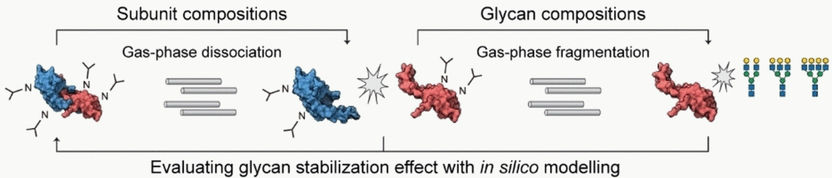
En la EM convencional, las moléculas se rompen en fragmentos, pero la EM nativa permite examinar los oligómeros proteicos plegados unidos a glicanos. En el método top-down, los oligómeros se separan posteriormente mediante una disociación en fase gaseosa y se miden. En un último paso, se utiliza la fragmentación en fase gaseosa para separar y analizar los glicanos. De este modo, es posible determinar las proporciones de monómeros y oligómeros presentes en un organismo o en un lote de medicamentos, así como los diferentes patrones de glicosilación que se producen y en qué cantidades.
Carol V. Robinson y Di Wu, de la Universidad de Oxford (Reino Unido), se concentraron en los glicanos situados en la interfaz entre dos subunidades y que pueden desempeñar un papel importante en la oligomerización. Compararon los resultados de sus mediciones con un modelo teórico calculado a partir de las subunidades disociadas. Esto permitió sacar conclusiones sobre el efecto de estabilización de los glicanos.
Una de las glicoproteínas terapéuticas que estudiaron fue el interferón-β (IFN-β), una citoquina antiinflamatoria que se utiliza para tratar enfermedades como la esclerosis múltiple. El IFN-β1a forma un homodímero asimétrico. Los análisis de EM mostraron que la mayoría de las formas primarias tanto del monómero como del dímero están glicosiladas. Sin embargo, para esta citoquina, la dimerización es independiente del estado de glicosilación.
Las cosas son diferentes para el factor de necrosis tumoral-α (TNF-α), una citoquina inflamatoria. Los biofármacos basados en anticuerpos que neutralizan el TNF-α se utilizan en casos de enfermedades autoinmunes, como la artritis reumatoide, la enfermedad de Crohn y la psoriasis. El TNF-α es un homotrímero con un glicano en la interfaz de cada subunidad. Los análisis de EM, y los experimentos con una pequeña molécula que interrumpe la trimerización, indicaron que los glicanos estabilizan significativamente el trímero del TNF-α.
Robinson y Wu también estudiaron la hormona estimulante del folículo (FSH, follitropina), un heterodímero formado por subunidades α y β. Los fármacos basados en la folitropina α se utilizan para tratamientos de fertilidad. El equipo descubrió una distribución inusual de glicanos en la subunidad α. Uno de estos glicanos interactúa ampliamente con la subunidad β y está claramente implicado en la regulación de la dimerización.
Los conocimientos adquiridos gracias a los experimentos de EM nativa descendente podrían ayudar a adaptar los glicanos en las proteínas terapéuticas para mejorar su estabilidad y eficacia.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.








































