Dinámica jerárquica
Los investigadores estudian la transducción de señales en las proteínas en muchas escalas de tiempo
Un árbol que se mueve con el viento: ¿Cuánto tiempo tarda el movimiento de una rama en llegar al tronco del árbol? ¿Y por qué vía se transmite este movimiento? Los investigadores de la Universidad Albert Ludwig están aplicando estas cuestiones a las proteínas, la maquinaria molecular de la célula. Un equipo dirigido por el Prof. Dr. Thorsten Hugel, del Instituto de Química Física, y el Dr. Steffen Wolf y el Prof. Dr. Gerhard Stock, del Instituto de Física, está investigando cómo las señales que provocan cambios estructurales en las proteínas viajan de un lugar a otro y con qué rapidez lo hacen. Dado que en esta transducción de señales intervienen muchas escalas de tiempo, desde nanosegundos hasta segundos, los científicos aún no han podido analizar el proceso exacto. Sin embargo, al combinar diferentes experimentos, simulaciones y estudios teóricos, los investigadores de Friburgo lo han conseguido. Han publicado sus resultados en la revista científica Chemical Science.
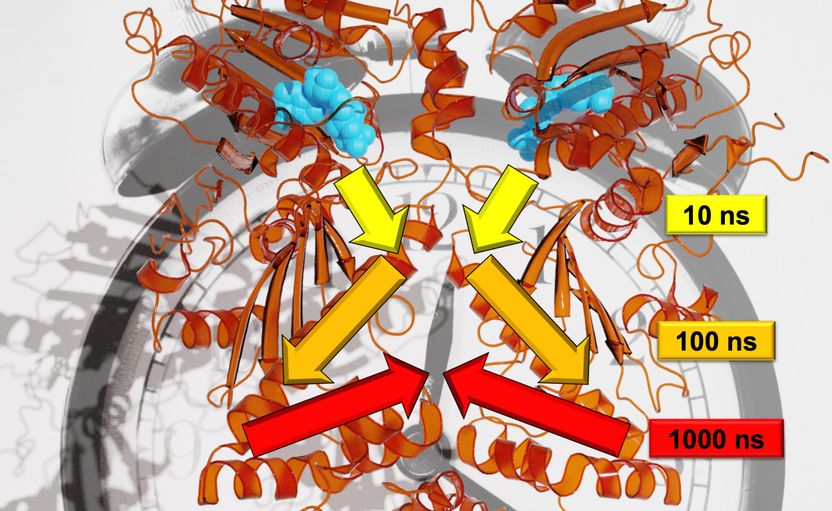
Los investigadores de Friburgo pudieron reconstruir el curso exacto de la transducción de señales en muchas escalas de tiempo.
Steffen Wolf
A diferencia de los árboles, los movimientos de la proteína Hsp90 investigados en el estudio se producen en escalas de tiempo logarítmicas: Cada movimiento mayor tarda unas diez veces más que los pequeños movimientos individuales que lo componen. "Por ejemplo, una rama se movería cada segundo, la rama cada 10 segundos y el tallo cada 100 segundos", explicó Wolf. Los diferentes métodos de investigación permitieron a los investigadores describir una interacción alostérica, es decir, mostrar cómo un proceso de reacción en la Hsp90 altera un sitio de unión a la proteína distante. El equipo descubrió que este proceso alostérico se produce a través de una dinámica jerárquica que abarca escalas de tiempo que van desde los nanosegundos hasta los milisegundos y escalas de longitud que van desde los picos hasta varios nanómetros, dijo Stock.
Además, el proceso de reacción en Hsp90 está acoplado a un cambio estructural en el único aminoácido Arg380. Arg380, a su vez, transmite información estructural a un subdominio de la proteína y, finalmente, a toda la proteína. La estructura alterada resultante cierra un sitio de unión central de la proteína, lo que le permite cumplir nuevas funciones. Los investigadores de Friburgo suponen que mecanismos jerárquicos similares, como el que se encuentra en la proteína Hsp90, son también de importancia fundamental en la transducción de señales en otras proteínas. Esto podría ser útil para el control de las proteínas mediante fármacos, dice Hugel.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Alemán se puede encontrar aquí.