MediGene: Hervorragende klinische Wirksamkeitsdaten von EndoTAG-1 bei Bauchspeicheldrüsenkrebs
EndoTAG®-1 zeigt in kontrollierter Phase II-Studie einen deutlichen Überlebensvorteil gegenüber der zugelassenen Standardtherapie und belegt Wirkprinzip von EndoTAG®-1
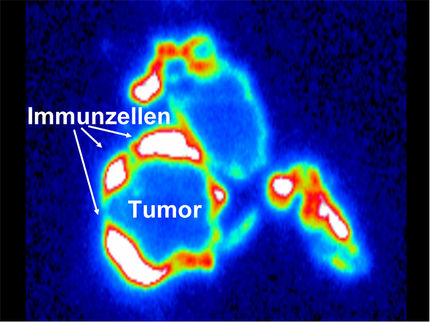
Die MediGene AG präsentierte die detaillierten Wirksamkeitsdaten des Medikamentenkandidaten EndoTAG®-1 aus einer kontrollierten klinischen Phase II-Studie zur Behandlung von Bauchspeicheldrüsenkrebs. EndoTAG®-1 bewirkt in dieser umfangreichen Studie deutliche Überlebensvorteile gegenüber der zugelassenen Standard-Therapie Gemcitabin. Erstmals wird hierdurch das neuartige Wirkprinzip von EndoTAG®-1 belegt, das auf das "Aushungern" von Tumoren durch die selektive Zerstörung von Tumorblutgefäßen zielt. Damit könnte EndoTAG®-1 für die Behandlung aller solider Tumorarten mit eigener Gefäßversorgung geeignet sein. Dies eröffnet vielfältige medizinische Möglichkeiten.
MediGene testete EndoTAG®-1 in der besonders schwer zu therapierenden Indikation Bauchspeicheldrüsenkrebs. Inoperabler Bauchspeicheldrüsenkrebs ist eine der aggressivsten Tumorarten überhaupt. Bei fortgeschrittener Erkrankung gibt es bisher keine wirksamen Therapiemöglichkeiten. Die in klinischen Vergleichsstudien mit bisherigen Therapien ermittelte mediane Überlebenszeit der Patienten beträgt nur etwa 6 - 7 Monate. Der zuletzt für diese Erkrankung zugelassene Wirkstoff Erlotinib erhielt die Marktzulassung aufgrund eines medianen Überlebensvorteils in der Kombinationstherapie von rund 2 Wochen gegenüber der Standardtherapie Gemcitabin. Seither wurden keine deutlichen Verbesserungen in zulassungsrelevanten klinischen Studien veröffentlicht.
Studienergebnisse: In der kontrollierten Phase II-Studie erhielten 200 Patienten mit Bauchspeicheldrüsenkrebs Gemcitabin (Kontrollarm) oder Gemcitabin in Kombination mit EndoTAG®-1 in drei verschiedenen Dosierungen. Dabei lag die mediane Überlebenszeit der mit Gemcitabin behandelten Patienten bei 7,2 Monaten. Die Kombinationstherapie mit Gemcitabin und EndoTAG®-1 führte dagegen zu einem dosisabhängigen Anstieg der medianen Überlebenszeiten auf 8,1 Monate, 8,8 Monate und 9,4 Monate in den drei EndoTAG®-Behandlungsgruppen. Die Rate des Sechsmonats-Überleben stieg ebenfalls dosisabhängig von 63,3% bei mit Gemcitabin behandelten Patienten auf 66,1%, 72,4% und 80,7% in den drei EndoTAG®- Gruppen. Die zweite Hälfte der in die Studie eingeschlossenen Patienten hatte in den EndoTAG®-Gruppen die Möglichkeit, über einen längeren Zeitraum und wiederholt mit EndoTAG®-1 behandelt zu werden. Die mediane Überlebenszeit dieser Patienten betrug je nach Dosierung sogar bis zu 11,5 Monate. Das bereits aus früheren Studien bekannte günstige Sicherheitsprofil von EndoTAG®-1 wurde nach bisherigem Kenntnisstand auch in der aktuellen Phase II-Studie bestätigt. Die vollständige Auswertung der Daten wird MediGene im vierten Quartal 2008 abschließen.
Meistgelesene News
Organisationen
Weitere News aus dem Ressort Forschung & Entwicklung

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Ab sofort nichts mehr verpassen: Unser Newsletter für Biotechnologie, Pharma und Life Sciences bringt Sie jeden Dienstag und Donnerstag auf den neuesten Stand. Aktuelle Branchen-News, Produkt-Highlights und Innovationen - kompakt und verständlich in Ihrem Posteingang. Von uns recherchiert, damit Sie es nicht tun müssen.