Auf dem Weg zur biologischen Variante
Alternativen zu wichtigen großtechnischen chemischen Verfahren möglich?
Die Arbeitsgruppe von Prof. Dr. Oliver Einsle am Institut für Biochemie der Universität Freiburg beschäftigt sich seit langer Zeit mit der Funktionsweise der Nitrogenase – und stellt nun die erste dreidimensionale Strukturanalyse der vanadiumhaltigen Variante des Enzyms vor. Daniel Sippel gelang im Rahmen seiner Promotionsarbeit die Produktion und Kristallisation einer Vanadium-Nitrogenase und darauf aufbauend die Aufklärung der Raumstruktur bei atomarer Auflösung durch Röntgenbeugungsexperimente. Langfristiges Ziel der Arbeitsgruppe ist es, die Nitrogenase biotechnologisch nutzbar zu machen und dadurch eine Alternative zu großtechnischen chemischen Verfahren zu eröffnen.
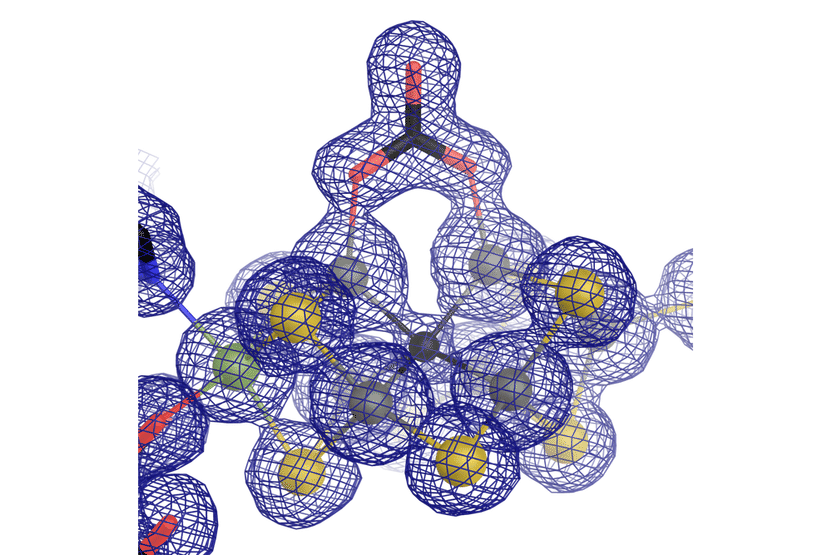
Das katalytische Zentrum der vanadiumhaltigen Nitrogenase, ein Eisen-Vanadium-Cofaktor mit einem ungewöhnlichen Carbonat-Liganden.
Grafik: Oliver Einsle
Das Element Stickstoff (N) ist ein wesentlicher Bestandteil aller biologischen Makromoleküle. Seine Verfügbarkeit in der Biosphäre ist dadurch limitiert, dass das weltweite Vorkommen von Stickstoff weitgehend auf das Gas N2 in der Atmosphäre beschränkt ist, dessen Stabilität ihn für die allermeisten Organismen unzugänglich macht. Zur Bereitstellung von bioverfügbarem Stickstoff als Düngemittel in der Landwirtschaft existiert seit 1906 das industrielle Haber-Bosch-Verfahren, das Stickstoff mit Wasserstoff zu Ammoniak verbindet. Seine Bedeutung ist heute so zentral, dass die Nahrungsproduktion für mehr als die Hälfte der Menschheit nur mithilfe von Stickstoffdüngern gewährleistet werden kann. In der Natur bewerkstelligt ein einziges Enzym, die bakterielle Nitrogenase, die gleiche Reaktion, ohne jedoch überschüssige Stickstoffverbindungen in die Umwelt abzugeben – Stichwort: Nitrate im Grundwasser. Allerdings ist die Funktion dieses komplexen, metallhaltigen Enzymsystems bislang nur unvollständig geklärt.
Einsles Arbeitsgruppe gelang schon zuvor ein wichtiger Schritt hin zum Verständnis der Nitrogenase: Die Forscher konnten die Aktivität des Enzyms durch das giftige Gas Kohlenmonoxid (CO) hemmen und zeigen, wie der Hemmstoff am Eisen-Molybdän-Cofaktor (FeMoco) bindet. Dieser ist das Zentrum der Nitrogenase so benannt nach den in ihm enthaltenen Elementen. FeMoco kann die Reaktion von Stickstoff und Wasserstoff katalysieren – die natürliche Version des Haber-Bosch-Verfahrens. Gleichzeitig war bekannt, dass eine Variante der Nitrogenase, die anstelle von Molybdän in ihrem aktiven Zentrum Vanadium benutzt und daher als FeVco bezeichnet wird, den Hemmstoff CO ebenfalls umsetzen kann. Produkt dieser Reaktion sind reduzierte Kohlenstoffverbindungen in Form kurzkettiger Kohlenwasserstoffe. Damit ist diese Reaktion die enzymatische Variante eines zweiten wichtigen chemischen Verfahrens, der Fischer-Tropsch-Synthese von Kohlenwasserstoffen, mit der großtechnisch Treibstoffe zum Beispiel aus Industrieabgasen hergestellt werden können.
Die Vanadium-Nitrogenase aus einem freilebenden Bodenbakterium vermag also unter dessen natürlichen Umgebungsbedingungen die gleiche Syntheseleistung zu erbringen, die in den industriellen Verfahren nur unter extremem Druck und bei hohen Temperaturen möglich ist. Die Haber-Bosch- und Fischer-Tropsch-Verfahren werden jährlich weltweit zur Umsetzung hunderter Millionen Tonnen der jeweiligen Gase – N2 und CO – genutzt, sodass an der Möglichkeit einer nachhaltigen, biologischen Alternative ein erhebliches Forschungsinteresse besteht.
Bei den Forschungsarbeiten zeigte sich, dass die Architektur des Enzyms zwar in großen Teilen der des molybdänhaltigen „Originals“ ähnelte, sich aber an einem wichtigen Punkt unterschied: dem atomaren Aufbau des katalytischen Cofaktors. Sippel und Einsle fanden, dass in FeVco tatsächlich ein Vanadiumion das Molybdänion ersetzt, aber zusätzlich ein Schwefelion des Zentrums durch ein – chemisch davon sehr verschiedenes – Carbonat-Anion ersetzt wird. Dieser nur auf den ersten Blick kleine Unterschied hat weitreichende Auswirkungen auf die geometrische und elektronische Struktur des Cofaktors.