Alzheimer-Fibrille gibt ihre besondere Struktur preis
Anzeigen
Wissenschaftler der Universität Ulm haben nun die molekulare Architektur von Beta-Amyloid-Fibrillen aufgedeckt. Diese fadenförmigen Eiweiß-Ablagerungen im Gehirn sind ein charakteristisches Merkmal der Alzheimer-Krankheit. Auf der Grundlage von Aufnahmen aus der Kryo-Elektronenmikroskopie konnten die Ulmer Forscher gemeinsam mit einem deutsch-amerikanischen Team die Molekülstruktur von so genannten Aß(1-42)-Fibrillen rekonstruieren, einer besonders schädlichen Variante des Beta-Amyloids.

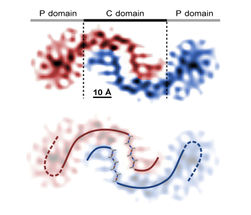
Rekonstruktiones eines Aß(1-42)-Peptiddimers, unten mit überlagertem Modell in beta-Faltblattstruktur in der Kernregion. Über eine Art Peptidreißverschluss sind die Moleküle miteinander verbunden
Matthias Schmidt; Copyright PNAS
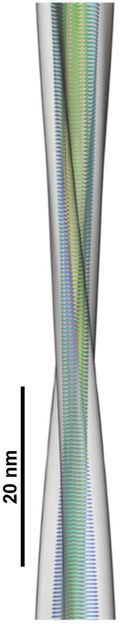
Modell einer Seitenansicht der Fibrillen-Rekonstruktion mit integrieren Modell der zentralen Region, die das „Rückgrat“ der Fibrille bildet.
Matthias Schmidt; Copyright PNAS

Wissenschaftler der Universität Ulm haben die molekulare Architektur von Beta-Amyloid-Fibrillen aufgedeckt. Diese fadenförmigen Eiweiß-Ablagerungen im Gehirn sind ein charakteristisches Merkmal der Alzheimer-Krankheit. „Man geht heute davon aus, dass die Bildung solcher Amyloid-Fibrillen über mehrere Zwischenstufen einen entscheidenden Beitrag zur Krankheitsentstehung spielt“, erklärt Professor Marcus Fändrich. Der Leiter des Instituts für Pharmazeutische Chemie an der Universität Ulm und sein Postdoc Dr. Matthias Schmidt haben erstmals – gemeinsam mit einem deutsch-amerikanischen Forscherteam – auf atomarer Ebene die Molekülstruktur von Aß(1-42)-Fibrillen identifiziert. Diese besonders schädliche Variante des Beta-Amyloids spielt auch bei neurodegenerativen Krankheiten wie eben Alzheimer eine Schlüsselrolle.
Zum Einsatz kam dabei ein besonderes mikroskopisches Verfahren, die sogenannte Kryo-Elektronenmikroskopie. Dieses Verfahren sorgt mit Temperaturen niedriger als minus 160° Celsius dafür, dass die tiefgekühlten bioaktiven Moleküle in ihrem natürlichen Umfeld untersucht werden können und nicht erst aufwändig kristallisiert werden müssen. „Am Rechner haben wir die mikroskopischen Aufnahmen mit Hilfe entsprechender Rekonstruktionssoftware in dreidimensionale Molekülmodelle umgewandelt, um die atomare Architektur der Peptid-Moleküle sichtbar zu machen“, so Schmidt. Der Hintergrund: die gewonnenen Strukturinformationen sollen dabei helfen, die Fibrillenbildung zu erklären. „Denn die Molekülstruktur beeinflusst natürlich den Ablauf von Aggregationsprozessen. Eine Schlüsselrolle spielen dabei nicht nur unterschiedliche Ladungsverteilungen oder polar wirkende atomare Gruppen, sondern nicht zuletzt das Wechselspiel von hydrophilen und hydrophoben Molekülabschnitten der beteiligten Aminosäuren“, erläutert der Biochemiker Fändrich.
Die Wissenschaftler fanden dabei heraus, dass das Rückgrat der Fibrille aus einer Art Peptidreißverschluss besteht, bei dem jeweils zwei Amyloid-Peptide in Form eines S-förmigen Dimers ineinander greifen. „Interessanterweise fanden wir im Inneren dieser Kernstruktur die hydrophoben Molekülabschnitte und außen die hydrophilen Gruppen, was chemisch gesehen Sinn macht“, so der 43-jährige Wissenschaftler. Die Fibrille besteht somit - vereinfacht gesagt - aus unzähligen solcher vertikal aufeinander geschichteten Dimere.
Mit den neuen Erkenntnissen lassen sich nicht nur bekannte physikalische und chemische Eigenschaften dieser Moleküle erklären, sondern auch biologische Phänomene besser verstehen. So konnte das Forscherteam zeigen, warum Aggregationshemmer besonders gut wirken, wenn sie die hydrophoben Abschnitte der sogenannten C-Termini im Kernbereich der Peptide angreifen. Sie lieferten zudem Evidenzen dafür, dass die Aß(1-42) Peptidvariante deshalb pathogener ist als das kürzere Peptid Aß(1-40). Bei der längeren Variante ist die Interaktionsfläche der gepaarten Moleküle vergrößert und damit auch die Aggregationsneigung höher. Fändrich und Kollegen konnten zudem eine mögliche Erklärung für bestimmte familiäre Veranlagungen für Alzheimer liefern. „Innerhalb der von uns gefundenen Struktur konnten wir bestimmte Aminosäuren identifizieren, die die Fibrillenstruktur offensichtlich stören. Sind diese aber im Menschen durch genetische Mutation entfernt, bricht die Krankheit wesentlich früher aus“, berichten die Forscher.



















































