Antibiotikum aus Muttermilch: Forscher entdecken neue Waffe gegen Bakterien
Anzeigen
Die zunehmende Resistenz von Bakterien gegen Antibiotika fordert von der Wissenschaft, Alternativen zur Bekämpfung von Infektionen zu finden. Viel versprechend sind neue Erkenntnisse der Arbeitsgruppe um Assoz. Prof. Dr. Karl Lohner am Institut für Molekulare Biowissenschaften der Karl-Franzens-Universität Graz. Den Forschern ist es gelungen, das in der Muttermilch vorkommende Lactoferricin in seiner natürlichen antibakteriellen Aktivität zu verstärken und dessen Wirkmechanismen aufzuklären. Die Studie, die einen wichtigen Beitrag zur Entwicklung innovativer Antibiotika leistet, wurde im Fachjournal PLOS ONE veröffentlicht.
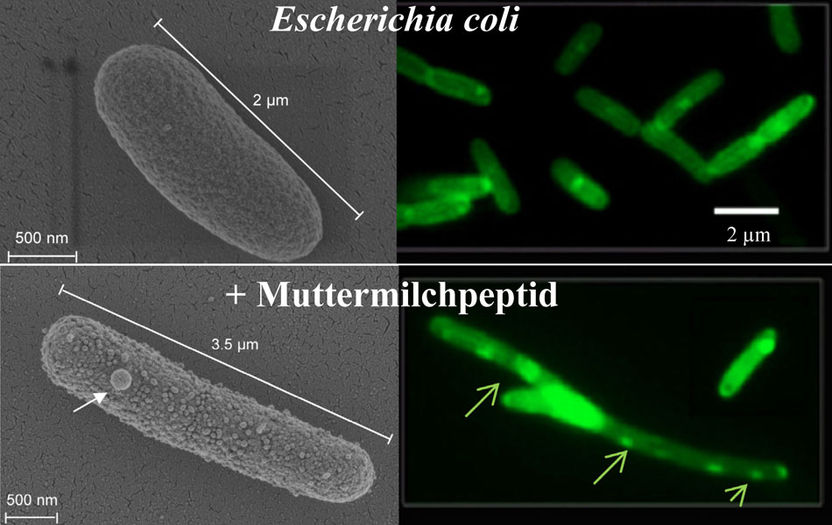
Elektronen- (l.) und Fluoreszenzmikroskopie (r.): Zellen des Bakteriums Escherichia coli ohne Einwirkung von Peptid (o.) und unter Einwirkung einer acylierten Variante von Lactoferricin (u.)
Dagmar Zweytick/Uni Graz
„Körpereigene Peptide – kleine Eiweißmoleküle – haben in der Abwehr von Bakterien einen Vorteil gegenüber herkömmlichen Antibiotika: Sie wirken direkt und schnell auf die Zellmembran, die Hülle des Bakteriums, und zerstören diese, noch bevor sich Resistenzen bilden können“, erklärt Ass.-Prof. Dr. Dagmar Zweytick vom Institut für Molekulare Biowissenschaften der Uni Graz. Die Forscherin aus dem Team von Karl Lohner ist Hauptautorin der vorliegenden Studie zu Lactoferricin. Dieses antibakterielle Peptid kommt in der Muttermilch vor. Allerdings ist es in seiner natürlichen Form zu schwach, um schwere Infektionen erfolgreich zu bekämpfen, daher wurde es im Rahmen eines EU-Projektes um Karl Lohner modifiziert. In Kooperation mit Kollegen der Universitäten Ljubljana und Houston/Texas hat Dagmar Zweytick beigetragen die Wirkmechanismen der Peptidvarianten aufzuklären.
Die Forscher haben die Aminosäure-Sequenz von Lactoferricin verändert und die Peptidderivate acyliert, sprich eine Fettsäurekette angehängt. Die anschließenden Untersuchungen zeigten, dass sowohl die acylierten als auch die nicht-acylierten Varianten die Zellmembran des Bakteriums Escherichia coli, das als Modellorganismus herangezogen wurde, stark schädigen. Die positiv geladenen Peptide docken an die negativ geladenen Lipide der Bakterienzellmembran an und brechen diese auf. Darüber hinaus stören die acylierten Peptide auch die Zellteilung und damit die Vermehrung der Bakterien. Die Peptidvarianten wurden bereits international patentiert.