Un enzima neutralizza gli agenti patogeni scindendo una tossina batterica
I ricercatori del Leibniz-HKI hanno scoperto un enzima che neutralizza il fattore di virulenza malleicyprol nei batteri patogeni umani
Annunci
Un team di ricerca del Leibniz-HKI descrive sulla rivista Angewandte Chemie International Edition un nuovo enzima che rende innocua la molecola altamente tossica del malleiciprolo. Il malleiciprolo è considerato un importante fattore di virulenza dei batteri Burkholderia, che causano, tra l'altro, la pericolosa malattia tropicale della melioidosi. La scoperta apre nuove strade per le strategie contro gli agenti patogeni resistenti agli antibiotici.
Burkholderia pseudomallei è considerato uno degli agenti patogeni batterici più pericolosi dei tropici. La malattia melioidosi, causata da questi batteri, è spesso grave e può essere fatale anche con il trattamento. "Ogni anno si registrano quasi 170.000 nuove infezioni in tutto il mondo e circa la metà delle persone colpite muore", riferisce Jonas Fiedler. Il dottorando è il primo autore della pubblicazione e lavora nel team di Christian Hertweck, professore di chimica dei prodotti naturali presso l'Università Friedrich Schiller di Jena e responsabile dello studio presso il Leibniz Institute for Natural Product Research and Infection Biology (Leibniz-HKI).
L'agente patogeno è pericoloso a causa della tossina malleicyprol, che attacca le cellule e causa la malattia. "Ciò è dovuto a una piccola struttura chimica altamente reattiva della molecola, il cosiddetto anello di ciclopropanolo", spiega Fiedler.
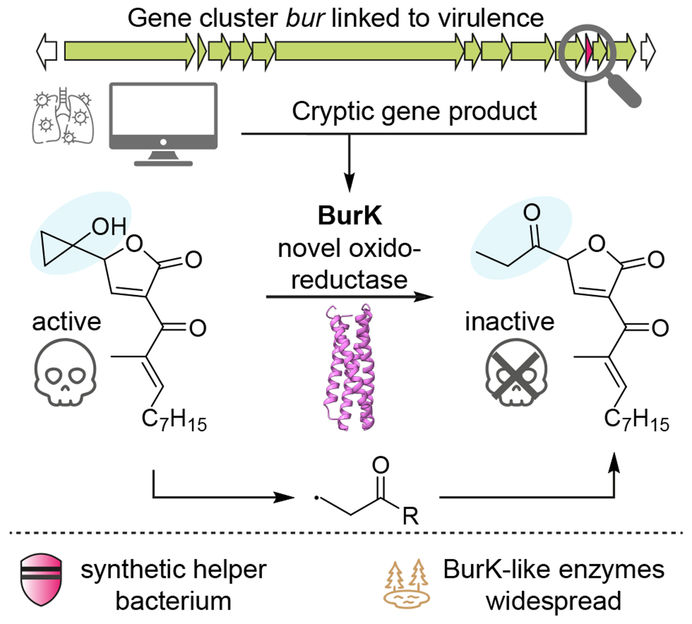
Rappresentazione schematica del meccanismo d'azione dell'enzima BurK: l'enzima scinde una struttura chimica altamente reattiva nella tossina batterica malleicoprol, rendendola così innocua. L'effetto patogeno della Burkholderia viene così ridotto.
Copyright: Jonas Fiedler, Leibniz-HKI
Un gene precedentemente trascurato codifica per un enzima che distrugge la parte reattiva della molecola.
Sebbene il malleiciprolo sia un fattore importante per la virulenza delle specie di Burkholderia e la sua biosintesi sia stata ampiamente compresa, la funzione di un enzima rimaneva poco chiara: "Abbiamo notato un piccolo gene che codifica per una proteina sconosciuta. Tuttavia, non siamo riusciti ad assegnare a questo prodotto genico alcuna funzione nella formazione della tossina. Volevamo colmare questa lacuna e abbiamo disattivato specificamente il gene per capirne il ruolo", ricorda Fiedler.
Sebbene i batteri continuassero a produrre il malleiciprolo tossico, improvvisamente mancava una variante inattiva della molecola. "Il gene deve quindi codificare un enzima che converte la tossina in questa forma innocua", ha detto Fiedler.
I ricercatori erano ora interessati a capire come esattamente l'enzima - chiamato BurK - modificasse la struttura molecolare. Nel processo, hanno scoperto un meccanismo straordinario: BurK utilizza composti contenenti ferro per generare particelle altamente reattive (radicali). Queste scindono l'anello del ciclopropanolo, che è cruciale per la tossicità, e rendono così il malleiciprolo innocuo. "È stata una vera sorpresa", spiega Fiedler. "Non si conosceva in precedenza alcun enzima in natura in grado di scindere specificamente l'anello del ciclopropanolo". Spiega poi: "Naturalmente, il batterio non disinnesca la tossina per proteggere gli esseri umani. Piuttosto, regola la quantità di tossina con l'aiuto dell'enzima BurK".
Protezione nell'organismo modello
Per verificare se BurK funziona anche in un sistema vivente, il team di ricerca ha inserito il gene responsabile nei batteri E. coli e poi li ha fatti incontrare con nematodi - minuscoli vermi filiformi - a cui è stato somministrato il malleiciprolo tossico. "I vermi che hanno ingerito la tossina insieme ai batteri contenenti BurK sono riusciti a sopravvivere meglio", riferisce Fiedler. I vermi di controllo che hanno ricevuto la tossina e i batteri senza l'enzima sono morti perché la tossina è rimasta efficace. Questo dimostra che BurK può neutralizzare il malleiciprolo anche negli organismi viventi.
I ricercatori hanno scoperto geni molto simili in altre specie batteriche, suggerendo che gli enzimi formati potrebbero svolgere un ruolo importante nell'interazione con altri organismi. Alcuni microrganismi potrebbero quindi potenzialmente proteggersi dalle tossine di altri batteri o addirittura proteggere i partner simbiotici - come i nematodi - dal malleicoprol nocivo.
Batteri geneticamente modificati contro gli agenti patogeni?
Anche se l'esatta funzione di questi enzimi in natura non è ancora chiara, sono ipotizzabili applicazioni pratiche per l'uomo: "Il batterio che abbiamo generato potrebbe essere usato terapeuticamente per neutralizzare il malleicoprol. Tuttavia, la sua trasferibilità alle infezioni umane deve ancora essere studiata a fondo", afferma Fiedler. Un'applicazione iniziale più realistica sarebbe nell'ambiente, ad esempio nelle regioni in cui i batteri Burkholderia sono naturalmente presenti nel suolo: "I terreni colpiti potrebbero essere decontaminati per ridurre gli effetti tossici", afferma Fiedler. "Anche questo dovrebbe essere testato a fondo prima".
In ogni caso, il team di ricerca dimostra che la natura ha un incredibile repertorio di strumenti, molti dei quali sono ancora nascosti all'uomo. L'enzima BurK ne è un esempio notevole. Il ricercatore capo Christian Hertweck riassume: "Il nostro lavoro dimostra che è possibile neutralizzare in modo specifico il pericolo di un agente patogeno senza doverlo uccidere direttamente. Questo apre nuove prospettive per il futuro trattamento dei batteri resistenti agli antibiotici e potrebbe diventare parte di nuove terapie a lungo termine".
Nota: questo articolo è stato tradotto utilizzando un sistema informatico senza intervento umano. LUMITOS offre queste traduzioni automatiche per presentare una gamma più ampia di notizie attuali. Poiché questo articolo è stato tradotto con traduzione automatica, è possibile che contenga errori di vocabolario, sintassi o grammatica. L'articolo originale in Inglese può essere trovato qui.




































