Découverte d'un stockage à grande vitesse du CO2 dans une bactérie
La crise climatique qui ne cesse de s'aggraver en raison de l'accumulation de dioxyde de carbone (CO2) dans l'atmosphère rend la recherche d'idées pour stocker le CO2 de plus en plus importante. L'équipe du professeur Ben Engel au Biozentrum de l'Université de Bâle, en collaboration avec des collègues des Universités de Francfort et de Marbourg, vient de mettre en lumière la structure d'une enzyme qui révèle une nouvelle façon de stocker le CO2.

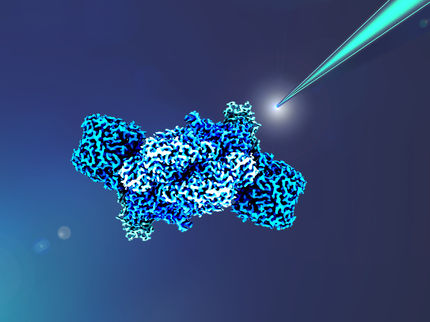
Les filaments de l'enzyme HDCR, qui produit de l'acide formique à partir d'hydrogène (H2) et de dioxyde de carbone (CO2) gazeux, sont enroulés les uns autour des autres comme une tresse.
Verena Resch/luminous-lab.com
L'enzyme inhabituelle HDCR produit de l'acide formique à partir d'hydrogène (H2) et de dioxyde de carbone (CO2) gazeux, éliminant ainsi le CO2 de l'environnement et le stockant dans la cellule. Au cours de ce processus, l'HDCR transfère des électrons de l'hydrogène au CO2. Il s'agit de la première enzyme connue capable d'utiliser directement l'hydrogène comme source d'électrons pour le stockage du CO2. L'enzyme HDCR a été découverte dans la bactérie Thermoanaerobacter kivui, qui aime la chaleur et qui a été découverte en 1981 dans le lac Kivu en Afrique centrale. Elle vit dans des environnements pauvres en oxygène, comme les grands fonds marins. Les équipes de recherche des universités de Bâle, de Francfort (professeur Volker Müller) et de Marbourg (professeur Jan Schuller) ont réussi à élucider la structure du HDCR. Les résultats ont été publiés dans la revue Nature.
Un catalyseur à grande vitesse
L'enzyme HDCR est composée de longs filaments. Cette structure filiforme agit comme un "nanofil" conducteur d'électrons qui est manifestement responsable des taux de conversion extrêmement efficaces des deux gaz. "C'est la structure de l'enzyme qui rend possible le stockage du CO2 à grande vitesse", explique le Dr Ricardo Righetto, l'un des premiers auteurs de l'étude au Biozentrum de l'Université de Bâle. Les chercheurs ont constaté que cette enzyme était plus rapide que tous les catalyseurs chimiques connus jusqu'alors pour effectuer cette réaction.
Les scientifiques ont appliqué des approches complémentaires de microscopie cryo-électronique pour comprendre le fonctionnement de la HDCR. Ils ont d'abord imagé des filaments purifiés en laboratoire, ce qui a permis de déterminer la structure atomique de l'enzyme. Les détails des filaments sont ainsi devenus visibles, révélant comment le "nanofil" contient des milliers d'amas d'atomes de fer et de soufre conducteurs d'électrons, qui permettent aux électrons de passer efficacement de l'hydrogène au CO2. Les scientifiques pensent que le "nanofil" peut également stocker les électrons de l'hydrogène lorsqu'une seule bulle d'hydrogène passe devant la bactérie.
Ils ont ensuite réalisé une tomographie de sections cellulaires congelées afin de visualiser les structures natives de la HDCR à l'intérieur des cellules de T. kivui . Cette technique de pointe a révélé que les filaments s'enroulent plusieurs fois sur eux-mêmes comme un câble métallique. "Nous avons été vraiment surpris non seulement de confirmer l'existence de filaments HDCR dans les cellules, mais aussi de constater qu'ils forment de grands faisceaux attachés à la membrane", déclare Righetto. Ces super-structures ressemblent à des "portails" circulaires sur la membrane. Cette disposition pourrait être importante pour augmenter l'efficacité de l'enzyme afin que la bactérie puisse obtenir de l'énergie dans des conditions aussi extrêmes."
Nouvelle possibilité de stockage du CO2
La crise climatique qui ne cesse de s'aggraver en raison de l'accumulation croissante de CO2 dans l'atmosphère rend indispensable le développement de nouvelles idées pour capturer et stocker le CO2. "La structure HDCR nous montre une nouvelle façon de stocker efficacement le CO2 en utilisant l'hydrogène comme source d'énergie", explique le professeur Ben Engel, chef de groupe au Biozentrum de l'Université de Bâle. "Cela pourrait s'avérer très utile pour les futures applications biotechnologiques. En même temps, notre étude démontre la valeur de la recherche scientifique fondamentale qui explore la biologie de divers organismes. La nature est pleine de surprises étonnantes !"
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.