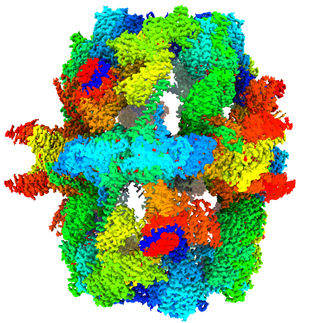
Biología estructural: Tijeras moleculares pilladas in fraganti
La estructura de una enzima crucial para la maduración del ARNt arroja luz sobre la causa de los trastornos neurodegenerativos
En todos los organismos vivos, la biomolécula ARN de transferencia (ARNt) desempeña un papel fundamental en la producción de proteínas. Los ARNt se generan a partir de moléculas precursoras en varios pasos. La enzima tRNA splicing endonuclease (TSEN), entre otras, cataliza un paso de este proceso. Las mutaciones en TSEN provocan un trastorno neurodegenerativo llamado hipoplasia pontocerebelosa, que se asocia a discapacidades graves y muerte prematura. Investigadores de la Universidad Goethe de Fráncfort y de la Universidad Johannes Gutenberg de Maguncia han deducido ahora la función de TSEN a partir de su estructura y, con ello, han allanado el camino en la búsqueda de sustancias activas contra la hipoplasia pontocerebelosa.
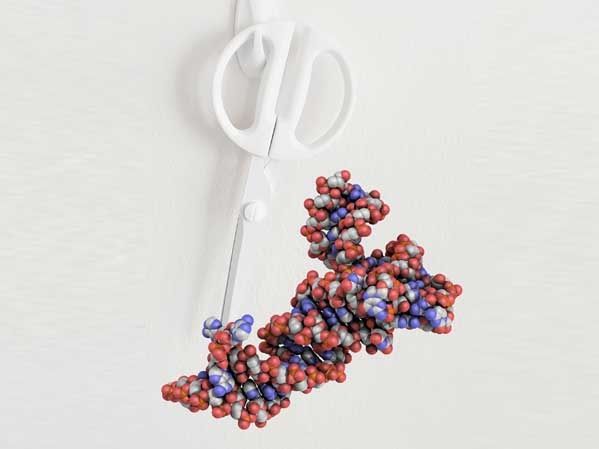
Recortado: Como unas tijeras, la enzima TSEN da forma al ARNt (coloreado) eliminando partes de la molécula precursora pre-ARNt.
Trowitzsch Lab, Goethe-Universität
Los ARN de transferencia (ARNt) se encuentran entre los tipos de ARN más comunes en una célula y son indispensables para la producción de proteínas en todos los organismos conocidos. Tienen una importante función de "traducción": Determinan cómo la secuencia de ácidos nucleicos, en la que está codificada la información genética, se transcribe en una secuencia de aminoácidos a partir de la cual se construyen las proteínas.
Los ARN de transferencia se generan a partir de ARNt precursores (pre-ARNt), que se convierten en varios pasos en el ARNt maduro con una compleja estructura tridimensional. En algunos ARNt, esto incluye un paso en el que se elimina una sección determinada, conocida como intrón. En los humanos, la endonucleasa de empalme del ARNt (TSEN) realiza esta tarea.
La enzima ARN quinasa CLP1, que se une directamente a TSEN, también desempeña un papel a la hora de garantizar la correcta conversión de los ARNt. Si TSEN y CLP1 no pueden interactuar entre sí debido a una mutación genética, parece que los ARNt tampoco pueden formarse correctamente. Las consecuencias de esto se ven a menudo en el desarrollo de trastornos neurodegenerativos. Uno de ellos es la hipoplasia pontocerebelosa, que provoca discapacidades graves y muerte prematura en la primera infancia. Este trastorno progresivo muy poco frecuente se manifiesta en un desarrollo anormal del cerebelo y el puente de Varolio, una parte del tronco encefálico.
Aunque la actividad de la TSEN es esencial para la vida, hasta la fecha no estaba muy claro cómo se une la enzima a los pre-ARNt y cómo se extirpan los intrones. La falta de una estructura tridimensional de la enzima también dificultaba la evaluación de los cambios desencadenados por mutaciones patógenas específicas. Mediante criomicroscopía electrónica (crioEM) realizada en instalaciones de la Universidad Julius-Maximilians de Würzburg y del Instituto de Bioquímica de la Universidad Goethe de Fráncfort, investigadores dirigidos por el Dr. Simon Trowitzsch, del Instituto de Bioquímica de la Universidad Goethe, han logrado ahora arrojar luz sobre la estructura tridimensional de un complejo TSEN/pre-ARNt.
Con la ayuda de sus reconstrucciones crio-EM, el equipo de investigación ha podido mostrar por primera vez cómo TSEN interactúa con el pre-ARNt en forma de L. A continuación, TSEN extirpa el intrón. A continuación, TSEN extirpa el intrón del brazo largo de la L. "Primero, TSEN se instala en la esquina de la L. Después puede reconocer tanto el brazo corto como el largo, así como el ángulo entre ambos", explica Trowitzsch.
La subunidad 54 de TSEN (TSEN54) desempeña un papel clave en el reconocimiento del pre-ARNt, como ahora han podido corroborar los investigadores. La subunidad sirve de "regla molecular" y mide la distancia entre el brazo largo y el corto de la L. De este modo, TSEN reconoce en qué punto debe escindirse el pre-ARNt para eliminar el intrón.
Los nuevos hallazgos sobre la interacción de la ARN quinasa CLP1 y la subunidad TSEN TSEN54 fueron una sorpresa: CLP1 se une evidentemente a una región no estructurada y, por tanto, muy flexible de TSEN54. Es precisamente esta región la que contiene un aminoácido mutado con mayor frecuencia en pacientes con hipoplasia pontocerebelosa. "Para nosotros, esto es un indicio importante de que el desarrollo de fármacos en el futuro debería concentrarse en mantener la interacción de TSEN y CLP1", está convencido Samoil Sekulovski, primer autor del estudio.
Los científicos esperan ahora que los datos estructurales permitan simular modelos que sirvan para buscar posibles sustancias activas. Trowitzsch resume: "Aunque una terapia prometedora está aún muy lejos de nosotros, nuestra estructura constituye de hecho una base sólida para comprender mejor cómo funciona la TSEN y cuáles son los patrones de enfermedad de sus mutantes".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.