Il modello all-in-one ricostruisce la complessa architettura del fegato
I ricercatori sviluppano un modello di organoide di nuova generazione per comprendere meglio le malattie del fegato
Annunci
Il fegato ha una struttura unica, soprattutto a livello di singole cellule. Gli epatociti, le principali cellule del fegato, rilasciano la bile in piccoli canali chiamati canalicoli biliari, che drenano nel dotto biliare nella regione periportale del fegato. Quando questo sistema di drenaggio della bile è interrotto, provoca danni e malattie al fegato. A causa di questa architettura unica, le indagini sulle malattie del fegato sono state limitate dalla mancanza di modelli coltivati in laboratorio che mostrassero accuratamente come la malattia progredisce, poiché è difficile ricreare la complessa struttura del fegato e le interazioni cellulari in un piatto. Gli attuali modelli di organoidi epatici derivati da tessuti sono costituiti da un solo tipo di cellula e non riescono a replicare la complessa composizione cellulare e l'architettura del tessuto, come la regione periportale del fegato.
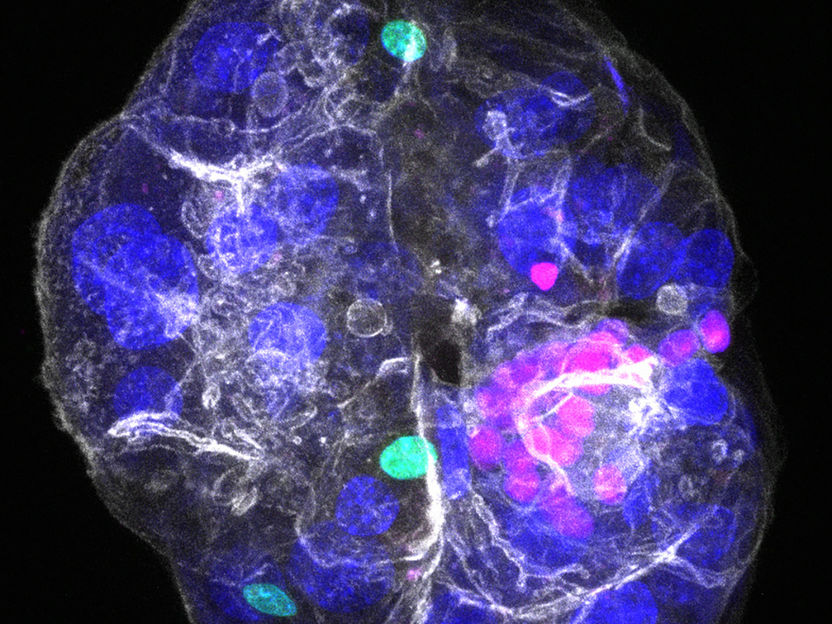
Assemblaggio periportale, con visualizzazione dei tre tipi di cellule che lo compongono: colangiociti in rosa, fibroblasti portali in verde e nuclei di epatociti in blu; tutti i confini cellulari sono visualizzati in bianco.
© Anna M. Dowbaj, Aleksandra Sljukic et al. Nature (2025) / MPI-CBG
Il gruppo di ricerca di Meritxell Huch, direttore del Max Planck Institute of Molecular Cell Biology and Genetics (MPI-CBG) di Dresda, in Germania, ha iniziato ad affrontare questo problema in un precedente studio del 2021 (Dynamic cell contacts between periportal mesenchyme and ductal epithelium act as a rheostat for liver cell proliferation, Cordero-Espinoza, Lucía et al, Cell Stem Cell, Volume 28, Issue 11, DOI) in cui i ricercatori hanno sviluppato un organoide epatico, composto da due tipi di cellule, colangiociti e mesenchima, in grado di modellare le interazioni cellula-cellula e la disposizione delle cellule, ma ancora privo di altri tipi di cellule periportali - soprattutto epatociti, la cellula che costruisce la maggior parte della massa epatica.
Creare un modello di organoide di nuova generazione
Nello studio attuale, pubblicato sulla rivista Nature, i ricercatori del gruppo di Meritxell Huch, insieme ai colleghi dei gruppi di Marino Zerial e Heather Harrington, entrambi direttori del MPI-CBG, sono riusciti a sviluppare un modello organoide di nuova generazione, che hanno chiamato "assembloide periportale". Questo assembloide presenta colangiociti adulti e cellule mesenchimali epatiche (come nel modello precedente), ma ora include anche epatociti, che sono le principali cellule funzionali del fegato adulto. Questo modello combina diverse cellule assemblate insieme in un processo graduale che si potrebbe paragonare al LEGO.
"Il nostro assembloide ricostruisce la regione periportale del fegato e può modellare gli aspetti della lesione epatica colestatica e della fibrosi biliare. Abbiamo scelto questa regione in particolare perché svolge un ruolo chiave nel trasporto della bile ed è spesso interrotta nelle malattie del fegato quando la connessione delle cellule responsabili del trasporto della bile è bloccata", spiega Anna Dowbaj, uno dei primi autori, ricercatrice post-dottorato nel gruppo di Huch e da giugno 2025 nominata professore assistente presso l'Università Tecnica di Monaco (TUM).
"Per raggiungere il nostro obiettivo, abbiamo prima creato degli organoidi composti solo da epatociti che formavano canali biliari funzionanti e mantenevano le caratteristiche principali degli epatociti reali nel tessuto. Poi abbiamo aggiunto colangiociti e cellule di fibroblasti per costruire assemblaggi periportali. Il nostro modello di fegato funziona come un vero tessuto epatico, spostando la bile dall'interno delle cellule epatiche ai dotti biliari, il che dimostra che siamo riusciti a replicare le interazioni tra le diverse cellule epatiche", spiega Aleksandra Sljukic, anch'essa prima autrice dello studio e dottoranda del gruppo di Huch.
Manipolando il numero di cellule mesenchimali, i ricercatori sono riusciti a innescare una risposta simile alla fibrosi epatica. Inoltre, sono riusciti a dimostrare che questo modello può essere utilizzato per studiare il ruolo di geni specifici nelle malattie del fegato, mescolando cellule normali e mutate o spegnendo i geni.
Utilizzando l'analisi topologica dei dati, Heather Harrington e i suoi colleghi dell'Università di Oxford hanno classificato le forme degli assembloidi e hanno scoperto che alcune forme erano correlate a una migliore funzione epatica nel tempo.
Lo studio delle malattie del fegato e una visione futura
Meritxell Huch, che ha supervisionato lo studio, conclude: "Siamo entusiasti di essere riusciti a creare un modello di assembloide periportale che combina, per la prima volta, mesenchima portale, colangiociti ed epatociti. Sebbene manchino ancora alcune cellule, in particolare l'endotelio e le cellule immunitarie, il modello cattura con grande precisione l'architettura cellulare e strutturale dell'area periportale del fegato alla scala di un piatto di coltura di tessuto. Inoltre, le sue caratteristiche modulari consentono di studiarlo, maneggiarlo e manipolarlo facilmente in laboratorio. I nostri assembloidi epatici sono il primo modello di laboratorio all-in-one che può essere utilizzato per studiare il flusso della bile, le lesioni del dotto biliare e il modo in cui le diverse cellule epatiche contribuiscono alla malattia".
Meritxell Huch continua: "Pensiamo che i nostri modelli epatici periportali possano essere utilizzati per studiare i meccanismi delle malattie. Una volta tradotti in cellule umane, potrebbero essere un modo per passare dai modelli 2D utilizzati negli screening farmaceutici a modelli 3D più fisiologici per studiare l'efficacia e la tossicità dei farmaci in un contesto più fisiologicamente rilevante".
Nota: questo articolo è stato tradotto utilizzando un sistema informatico senza intervento umano. LUMITOS offre queste traduzioni automatiche per presentare una gamma più ampia di notizie attuali. Poiché questo articolo è stato tradotto con traduzione automatica, è possibile che contenga errori di vocabolario, sintassi o grammatica. L'articolo originale in Inglese può essere trovato qui.
Pubblicazione originale
Anna M. Dowbaj, Aleksandra Sljukic, Armin Niksic, Cedric Landerer, Julien Delpierre, Haochen Yang, Aparajita Lahree, Ariane C. Kühn, David Beers, Helen M. Byrne, Sarah Seifert, Heather A. Harrington, Marino Zerial, Meritxell Huch; "Mouse liver assembloids model periportal architecture and biliary fibrosis"; Nature, 2025-5-29






































