Juntos son más eficientes
La proximidad entre enzimas idénticas puede conducir a una mejora sustancial de su eficacia catalítica
Las enzimas acopladas mecánicamente muestran un aumento de su eficacia catalítica: éste es el resultado de un estudio del grupo de Ramin Golestanian y Jaime Agudo-Canalejo, del Instituto Max Planck de Dinámica y Autoorganización. Los investigadores llegaron a la conclusión de que las enzimas pueden beneficiarse de la cooperación y evitar la energía de activación necesaria para las enzimas individuales. De este modo, dos enzimas pueden trabajar mano a mano para lograr un recambio global más rápido de una reacción química.
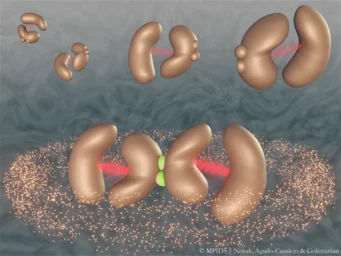
Cuando dos enzimas se acoplan mecánicamente entre sí, pueden sincronizarse y potenciar enormemente su actividad catalítica. En esta representación artística, cada enzima está compuesta por dos subunidades unidas por un enlace flexible (rojo), y dos enzimas pueden unirse entre sí (verde) para formar un complejo acoplado mecánicamente
© MPIDS / Novak, Agudo-Canalejo, Golestanian
Se sabe que, en los sistemas biológicos, las enzimas se agrupan en racimos que favorecen la actividad catalítica de estas moléculas esenciales. Por lo general, se ha supuesto que la proximidad entre diferentes enzimas es beneficiosa: si la molécula de producto de la reacción catalizada por una enzima se utiliza posteriormente en la reacción catalizada por otro tipo de enzima, lo que da lugar a que las enzimas se "pasen" las moléculas de una a otra. Sin embargo, también se ha observado un aumento de la eficacia cuando las enzimas del mismo tipo, que catalizan la misma reacción, se agrupan. Hasta ahora no se comprendía la ventaja de esta organización, pero el nuevo estudio demuestra que la proximidad entre enzimas idénticas puede dar lugar a una mejora sustancial de su eficiencia catalítica.
"Hemos demostrado que el acoplamiento mecánico entre enzimas cercanas puede hacer que se sincronicen y, al mismo tiempo, potenciar su actividad catalítica", afirma Jaime Agudo-Canalejo, primer autor del estudio. Explica: "De hecho, lo que normalmente sería un único evento catalítico para una enzima aislada se convierte en una ráfaga de muchos eventos catalíticos cuando dos enzimas interactúan entre sí".
Un principio común en biología
Existen otros ejemplos de sincronización en un contexto biológico. Un ejemplo destacado son los cilios, que laten de forma coordinada y periódica para permitir el transporte lateral. Del mismo modo, las células cardíacas siguen un patrón sincrónico para garantizar el latido periódico del corazón.
En la misma línea, ahora se ha descrito que la actividad enzimática general se beneficia de la sincronización mutua: "Es muy emocionante saber que las enzimas han evolucionado para aprovechar estrategias tan sofisticadas para funcionar de forma cooperativa y eficiente a escala molecular. Este mecanismo puede ser ventajoso en los procesos de señalización que requieren una respuesta coordinada a una entrada externa. Además, un aumento de la catálisis debería tener importantes consecuencias en el metabolismo celular", explica Ramin Golestanian, investigador principal del estudio y director del MPIDS.
Nueva física a escala molecular
El mecanismo de sincronización desvelado en este trabajo implica a las enzimas que sufren pequeños cambios de forma durante un paso catalítico. Cuando dos enzimas de este tipo están cerca, ya sea directamente unidas entre sí o interactuando indirectamente a través del medio físico circundante (por ejemplo, una membrana celular), la expansión de una enzima provocará la contracción de la otra. De este modo, se turnan para impulsarse mutuamente en su ciclo catalítico. Según el modelo, esto puede crear una larga ráfaga de actividad catalítica, que durará hasta que una fluctuación térmica acabe por detener la actividad catalítica global del complejo enzimático. Además, el inicio de la cooperatividad se consigue mediante una transición topológica, lo que hace que el fenómeno sea especialmente fascinante a un nivel más fundamental.
"El mecanismo que hemos descubierto en este sistema a escala molecular representa un nuevo tipo de mecanismo de sincronización, que es cualitativamente diferente de los presentes en sistemas a mayor escala estudiados anteriormente", concluye Ramin Golestanian. "El modelo abre así una plétora de nuevas vías de investigación en este campo".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.