La structure moléculaire de l'un des récepteurs les plus importants du système immunitaire a été élucidée.
Des chercheurs publient la structure tridimensionnelle du récepteur de l'antigène des cellules B, jetant un nouvel éclairage sur sa composition
La surface des cellules B est couverte de récepteurs d'antigènes grâce auxquels elles reconnaissent les agents pathogènes envahissants tels que les bactéries et les virus. Lorsqu'un récepteur de cellule B se lie à un antigène, c'est-à-dire à une structure étrangère, la cellule B est activée et déclenche la production d'anticorps. Les anticorps sont essentiels à notre survie et nous protègent contre les maladies graves dues à des infections par des agents pathogènes tels que le COVID-19. Les vaccins ont un effet protecteur car ils activent les récepteurs d'antigènes, déclenchant ainsi une réponse immunitaire. Une équipe internationale de chercheurs du Pôle d'excellence CIBSS de l'Université de Fribourg et de la Harvard Medical School, aux États-Unis, vient de publier la structure moléculaire exacte d'un récepteur de cellules B de type IgM. Leurs résultats indiquent que le récepteur à la surface de la cellule B interagit avec d'autres récepteurs, contrôlant ainsi la transduction de son signal. L'étude a été publiée dans la revue Nature.
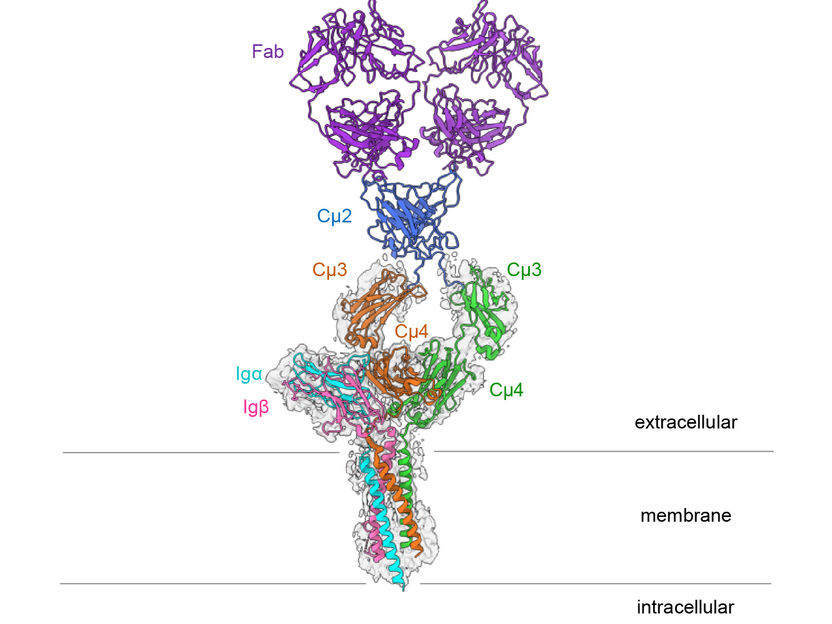
Structure du récepteur des cellules B de l'IgM de la souris.
Hao Wu/Harvard Medical School
Connexion des sous-unités de signalisation avec l'immunoglobuline
Le récepteur d'antigène des cellules B se compose d'un anticorps lié à la membrane cellulaire et de deux protéines plus petites, les Ig alpha et Ig bêta. Ces petites sous-unités transmettent des signaux à l'intérieur de la cellule dès que le récepteur des cellules B identifie un agent pathogène. "Michael Reth, de la faculté de biologie de l'université de Fribourg, qui mène des recherches sur le récepteur depuis plus de 30 ans et a découvert ses sous-unités de signalisation. Il est membre du pôle d'excellence CIBSS (Centre for Integrative Biological Signalling Studies) et codirecteur du pôle d'excellence BIOSS. "Pendant longtemps, nous n'avions pas les possibilités techniques d'étudier la structure exacte des protéines membranaires. Maintenant, la microscopie cryo-électronique nous a permis de créer une image à haute résolution du récepteur des cellules B", explique Reth.
Avec la microscopie cryo-électronique, l'échantillon à étudier est refroidi très rapidement à moins 183 °C. Cela réduit le mouvement naturel des molécules. Cela réduit le mouvement naturel des molécules et empêche la formation de minuscules cristaux de glace qui, sinon, détruiraient la structure des protéines. De cette manière, il est possible d'atteindre des résolutions plusieurs fois supérieures à celles des autres méthodes de microscopie électronique. Dans leur étude actuelle, les chercheurs ont atteint une résolution de 3,3 ångströms, ce qui correspond à la largeur de quelques atomes seulement. Pour ce faire, ils ont combiné des centaines de milliers d'images du récepteur entier avec celles d'une version tronquée, dépourvue de deux régions flexibles. Ils ont ensuite utilisé ces données pour calculer sur ordinateur la structure tridimensionnelle complète du récepteur des lymphocytes B.
L'anticorps symétrique lié à la membrane ne se lie que d'un seul côté
Ce qui frappe dans la structure tridimensionnelle, c'est que l'anticorps symétrique lié à la membrane ne se lie aux Ig alpha et aux Ig bêta que d'un seul côté, formant ainsi un complexe asymétrique. Cette asymétrie ressemble à celle du récepteur des cellules T, un autre récepteur immunitaire important dont la structure a été élucidée pour la première fois en 2019. "Il est stupéfiant que les deux types de récepteurs d'antigènes forment des complexes asymétriques", explique Reth. "Cela nous amène à conclure que la structure maintenant élucidée fait partie d'un plus grand complexe de récepteurs et qu'elle interagit avec encore d'autres molécules à la surface des cellules B."
De telles structures plus grandes, qui sont maintenues ensemble par des forces moins puissantes, ne peuvent pas encore être étudiées avec des techniques comme la microscopie cryo-électronique. Cependant, la structure moléculaire nouvellement publiée fournit des preuves supplémentaires en faveur d'une telle interaction avec d'autres molécules : Elle montre que l'extérieur du récepteur des cellules B contient des acides aminés conservés. Les acides aminés sont dits conservés s'ils ne changent pratiquement pas au cours de l'évolution et sont donc identiques dans les récepteurs d'antigènes de différents organismes. "La présence d'acides aminés conservés qui sont dirigés vers l'extérieur suggère que le récepteur des cellules B de l'IgM a d'autres partenaires de liaison", explique Reth. "En d'autres termes, nous ne connaissons qu'une partie de la machine jusqu'à présent - et nous voulons maintenant identifier les autres éléments constitutifs et déterminer comment ils influencent l'effet de signalisation du récepteur."
Ces autres éléments constitutifs pourraient expliquer comment le récepteur est normalement maintenu quiescent et n'est activé que lorsqu'il se lie à un antigène. "Ce sera l'une des prochaines tâches importantes dans l'étude de l'immunité adaptative", résume Reth. "Une meilleure compréhension de l'activation des cellules B pourrait également nous aider à améliorer encore le développement des vaccins ou à comprendre la formation des lymphomes dans lesquels le récepteur des cellules B est activé de manière incontrôlée."
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.