Les chaperons moléculaires pris en flagrant délit
L'analyse de la structure aux rayons X montre comment les molécules du CMH I sont préparées pour le chargement des peptides.
Pour une réponse immunitaire adéquate, il est essentiel que les lymphocytes T reconnaissent les cellules infectées ou dégénérées. Ils le font au moyen de peptides antigéniques, que ces cellules présentent à l'aide de molécules de surface spécialisées (molécules du CMH I). Grâce à l'analyse de la structure aux rayons X, une équipe de recherche de Francfort a pu montrer comment les molécules du CMH I sont chargées de peptides et comment les peptides appropriés sont sélectionnés à cette fin.
En tant que forces opérationnelles du système immunitaire adaptatif, les lymphocytes T sont chargés d'attaquer et de tuer les cellules infectées ou cancéreuses. Ces cellules, comme presque toutes les cellules du corps humain, présentent à leur surface des fragments de toutes les protéines qu'elles produisent à l'intérieur. Si ceux-ci comprennent des peptides qu'un lymphocyte T reconnaît comme étrangers, le lymphocyte est activé et tue la cellule en question. Il est donc important, pour une réponse robuste des lymphocytes T, que des fragments de protéines appropriés leur soient présentés. L'équipe de recherche dirigée par Simon Trowitzsch et Robert Tampé, de l'Institut de biochimie de l'Université Goethe de Francfort, vient de faire la lumière sur la manière dont la cellule sélectionne ces fragments de protéines ou peptides.
La présentation des peptides a lieu sur les molécules du complexe majeur d'histocompatibilité de classe I (CMH I). Les molécules du CMH I sont un groupe de protéines de surface très diverses qui peuvent fixer des myriades de peptides différents. Elles sont ancrées dans la membrane cellulaire et forment une poche de fixation des peptides avec leur partie tournée vers l'extérieur. Comme toutes les protéines de surface, les molécules du CMH I empruntent la voie dite sécrétoire : elles sont synthétisées dans le système de cavités de la cellule (réticulum endoplasmique (RE) et appareil de Golgi) et y sont repliées. De petites vésicules se détachent ensuite du système cavitaire, migrent vers la membrane cellulaire et fusionnent avec elle.
Le processus de maturation des molécules du CMH I est très strictement contrôlé : dans le RE, des protéines appelées "chaperons" les aident à se plier. La chaperonne tapasin est essentielle au chargement des peptides dans ce processus. "Lorsqu'une molécule du CMH I a lié un peptide, la tapasine vérifie le degré de solidité de la liaison", explique Trowitzsch pour expliquer la tâche du chaperon. "Si la liaison est instable, le peptide est retiré et remplacé par un autre qui se lie étroitement". Cependant, il n'a pas encore été possible de clarifier comment la tapasine accomplit exactement cette tâche - notamment parce que le processus de chargement est extrêmement rapide.
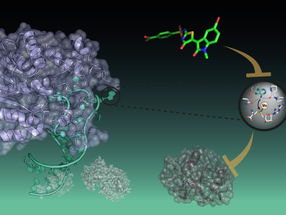
Les biochimistes et les biologistes structurels de l'université Goethe de Francfort ont réussi pour la première fois à visualiser l'interaction de courte durée entre le chaperon et la molécule du CMH I au moyen de l'analyse de la structure aux rayons X. Pour ce faire, ils ont produit des variantes du chaperon et de la molécule. Pour ce faire, ils ont produit des variantes des deux partenaires d'interaction qui n'étaient plus intégrées à la membrane, les ont purifiées et les ont réunies. Une astuce a permis de capturer le complexe de chargement en action pour la cristallisation : l'équipe de recherche a d'abord chargé la molécule du CMH I avec un peptide de haute affinité de manière à créer un complexe stable. Un signal lumineux a déclenché le clivage du peptide, ce qui a fortement réduit sa capacité à se lier à la molécule du CMH I. Immédiatement, la tapasine entre en scène et reste liée à la molécule du CMH I dépourvue de son peptide. "Le clivage photo-induit du peptide a été déterminant pour le succès de notre expérience", explique Tampé. "Grâce à cette biologie opto-chimique, nous pouvons désormais reproduire systématiquement des processus cellulaires complexes, un par un."
L'analyse de la structure aux rayons X des cristaux a révélé comment la tapasine élargit la poche de liaison peptidique de la molécule du CMH I, testant ainsi la force de la liaison peptidique. À cette fin, les partenaires d'interaction forment une grande zone de contact ; pour la stabilisation, une boucle de tapasine se trouve au-dessus de la poche de liaison élargie. "C'est la première fois que nous montrons le processus de chargement à haute résolution", se réjouit Mme Tampé. Les images révèlent également comment un chaperon unique peut interagir avec l'énorme diversité des molécules du CMH I, explique le biochimiste : "La tapasine se lie précisément aux régions non variables des molécules du CMH I". Cependant, la nouvelle structure n'améliore pas seulement notre compréhension des processus complexes impliqués dans le chargement des molécules du CMH I. Elle devrait également permettre de sélectionner des candidats appropriés pour le traitement des maladies infectieuses. Elle devrait également aider à sélectionner des candidats appropriés pour le développement de vaccins.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.