Un nouvel outil pour la microscopie cryo-électronique
Une nouvelle méthode qui combine la cryo-EM avec une méthode autrement utilisée dans la recherche sur les matériaux
Des chercheurs du Forschungszentrum Jülich et de l'université Heinrich Heine de Düsseldorf, dirigés par le professeur Carsten Sachse, utilisent la microscopie cryo-électronique, ou cryo-EM, pour rendre les biomolécules visibles au niveau atomique. Dans un article publié aujourd'hui dans la revue Nature Methods, ils présentent une nouvelle méthode qui combine la cryo-microscopie électronique avec une autre méthode utilisée dans la recherche sur les matériaux. Les résultats sont également présentés et classés dans un Nature Briefing.
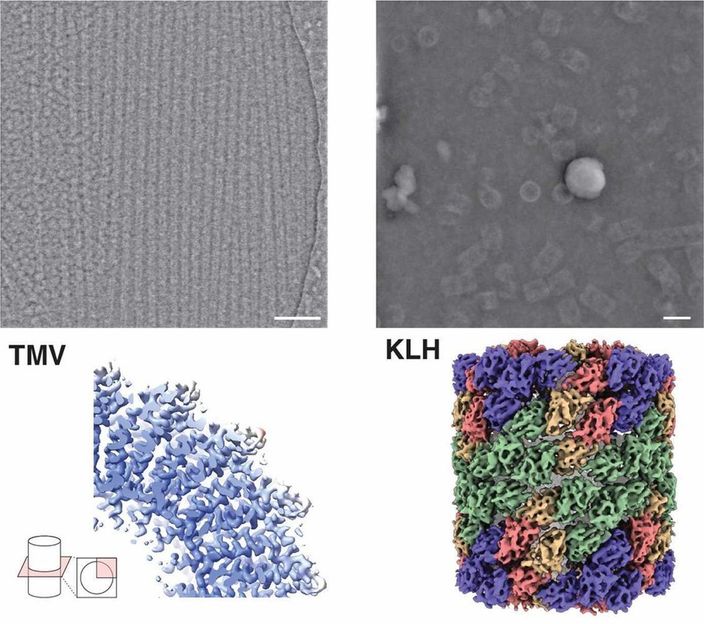
Image microscopique (en haut) et structure (en bas) de la protéine hémocyanine (à droite) et du virus de la mosaïque du tabac (à gauche) par iDPC-STEM. En dessous, les structures 3D correspondantes à une résolution de 3,5 et 6,5 Å.
Forschungszentrum Jülich / Ivan Lazic, Carsten Sachse
La technique encore relativement nouvelle de la cryo-EM présente un avantage décisif par rapport à la cristallographie aux rayons X, utilisée de manière routinière depuis des décennies : Les éléments constitutifs des protéines peuvent être observés dans leur environnement naturel, à l'état congelé, sans avoir à les transformer au préalable en un cristal artificiel. La cryo-EM est basée sur la microscopie électronique à transmission. La méthode alternative utilisée par les chercheurs est un perfectionnement de la microscopie électronique à transmission à balayage avec contraste de phase différentiel intégré (iDPC-STEM).
"Cette méthode a jusqu'à présent été utilisée principalement dans la recherche sur les matériaux, où elle a déjà permis d'atteindre des résolutions très élevées. Pour l'imagerie d'échantillons biologiques, nous avons maintenant atteint directement une qualité qui a été rendue possible pour la première fois par la cryo-microscopie électronique il y a quelques années", explique Carsten Sachse, directeur du Ernst Ruska-Centre du Forschungszentrum Jülich et professeur à l'université Heinrich Heine de Düsseldorf.
Avec des partenaires de recherche de la société d'analyse Thermo Fischer Scientific à Eindhoven, il a pu cartographier les structures des protéines à l'aide de l'iDPC-STEM avec une résolution inférieure au nanomètre de 3,5 angströms. "La microscopie cryo-électronique est aujourd'hui un peu plus avancée en comparaison. Mais nos résultats montrent que l'iDPC-STEM est en principe capable, moyennant quelques optimisations, d'atteindre des résolutions similaires à celles de la cryo-microscopie électronique actuelle et d'élargir les possibilités d'analyse structurelle, en particulier pour les échantillons très hétérogènes et non uniformes ou les particules uniques lorsque les capacités de calcul de la moyenne sont limitées", explique Carsten Sachse.
Dans la cryo-microscopie électronique classique, des milliers, voire des dizaines ou des centaines de milliers, de clichés d'un échantillon sont pris dans de nombreuses directions d'observation. Un ordinateur puissant utilise ces images pour calculer un modèle tridimensionnel détaillé de la molécule ou de la particule. La microscopie électronique à balayage, quant à elle, balaie les objets ligne par ligne, par petites étapes, pour produire une image composite qui, comme dans la cryo-EM conventionnelle, sert de base au calcul de la structure tridimensionnelle. Comme pour la cryo-microscopie électronique, un faisceau d'électrons à faible dose est utilisé car les biomolécules sont généralement extrêmement sensibles. Cela permet d'éviter que la haute énergie du faisceau ne détruise les structures sensibles.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.